Hvorfor er diamant så hårdt et ikke-reaktivt stof?
1. Kovalent binding:
- Diamanter er udelukkende sammensat af kulstofatomer arrangeret i en meget stiv og tætpakket krystallinsk struktur kendt som en diamant kubisk struktur.
- Hvert kulstofatom i en diamant danner kovalente bindinger med dets fire nabokulstofatomer, hvilket skaber en meget stabil elektronkonfiguration.
- Kovalente bindinger involverer deling af elektroner mellem atomer, hvilket resulterer i en stærk interatomisk kraft, der holder carbonatomerne tæt sammen.
2. Tetraedrisk bindingsarrangement:
- I den diamantkubiske struktur er hvert kulstofatom placeret i midten af et tetraeder, omgivet af fire andre kulstofatomer i hjørnerne.
- Dette tetraedriske arrangement resulterer i en symmetrisk og ensartet fordeling af elektroner, hvilket fører til enestående styrke og stabilitet.
3. Stærke kulstof-kulstofbindinger:
- De kovalente bindinger mellem kulstofatomer i en diamant er utrolig stærke med en bindingsenergi på 348 kilojoule pr. mol.
- Denne høje bindingsenergi opstår fra kulstoffets høje elektronegativitet, som gør, at elektronerne deles ligeligt mellem atomerne, hvilket skaber en stærk tiltrækning og en lav tendens til at reagere med andre grundstoffer.
4. Mangel på defekter:
- En diamants renhed spiller en afgørende rolle for dens hårdhed og ikke-reaktivitet.
- Diamanter med færre defekter, såsom tomrum, urenheder eller dislokationer, har en mere robust og ensartet krystalstruktur, hvilket gør dem mere modstandsdygtige over for deformation og kemiske reaktioner.
5. Høj termisk ledningsevne:
- Diamanter har en usædvanlig høj varmeledningsevne, som giver dem mulighed for at aflede varme effektivt.
- De stærke kovalente bindinger i diamanter letter den hurtige overførsel af varme gennem krystalgitteret, forhindrer lokal opvarmning og beskytter diamantens struktur.
Som et resultat af disse unikke strukturelle egenskaber og stærke kovalente bindinger har diamanter en bemærkelsesværdig hårdhed, hvilket gør dem til det hårdeste naturlige materiale, der er kendt på Jorden. De er også modstandsdygtige over for kemiske reaktioner og transformationer, hvilket gør dem meget ikke-reaktive og ikke-reaktive i de fleste miljøer.
Sidste artikelHvad er virkningen af HCl på forbrændt Mg-strimmel?
Næste artikelHvorfor er tætheden af et stof vigtig?
 Varme artikler
Varme artikler
-
 Ny undersøgelse finder unøjagtigheder i arseniske testsæt i BangladeshEfter en række trin med forskellige kemiske reagenser, farven, der udvikler sig på en teststrimmel, sammenlignes med et referenceskema leveret af sættets producent. En mørkere farve indikerer en højer
Ny undersøgelse finder unøjagtigheder i arseniske testsæt i BangladeshEfter en række trin med forskellige kemiske reagenser, farven, der udvikler sig på en teststrimmel, sammenlignes med et referenceskema leveret af sættets producent. En mørkere farve indikerer en højer -
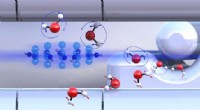 Sammenligning af vandisomerers kemiForsorterede ortho-vand- og para-vand-molekyler med forskelligt orienterede nukleare spins (blå eller røde pile) reagerer med diazenyliumioner (i midten til venstre) ved forskellige hastigheder. Kredi
Sammenligning af vandisomerers kemiForsorterede ortho-vand- og para-vand-molekyler med forskelligt orienterede nukleare spins (blå eller røde pile) reagerer med diazenyliumioner (i midten til venstre) ved forskellige hastigheder. Kredi -
 Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice
Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice -
 Forskere, der arbejder på at genvinde sjældne jordarters grundstoffer og sikre kritiske materialer…Forskere ved Oak Ridge National Laboratory kaster lys over kemiske separationer for at genvinde sjældne jordarters grundstoffer. Kredit:Ben Doughty/ORNL, U.S.A. Dept. of Energy Forskere ved Oak Rid
Forskere, der arbejder på at genvinde sjældne jordarters grundstoffer og sikre kritiske materialer…Forskere ved Oak Ridge National Laboratory kaster lys over kemiske separationer for at genvinde sjældne jordarters grundstoffer. Kredit:Ben Doughty/ORNL, U.S.A. Dept. of Energy Forskere ved Oak Rid


