Hvad er de to typer binære forbindelser?
1. Ioniske binære forbindelser:Disse forbindelser dannes af den kemiske binding mellem et metal og et ikke-metal, hvilket resulterer i overførsel af elektroner fra metallet til ikke-metallet. Den elektrostatiske tiltrækning mellem de positivt ladede metalioner (kationer) og de negativt ladede ikke-metalioner (anioner) holder den ioniske forbindelse sammen. Ioniske binære forbindelser er typisk sprøde, har høje smeltepunkter og er gode ledere af elektricitet, når de opløses i vand eller smeltes. Eksempler omfatter natriumchlorid (NaCl), kaliumiodid (KI) og magnesiumoxid (MgO).
2. Kovalente binære forbindelser:Disse forbindelser dannes af den kemiske binding mellem to ikke-metalatomer, hvor de deler elektroner for at færdiggøre deres yderste elektronskaller. Kovalente binære forbindelser kan yderligere klassificeres i to typer:
a) Polære kovalente binære forbindelser:I polære kovalente binære forbindelser deles elektronerne ikke ligeligt mellem atomerne. Denne ulige deling resulterer i en delvis positiv ladning på det ene atom og en delvis negativ ladning på det andet, hvilket skaber en polær binding. Eksempler omfatter hydrogenchlorid (HCl) og kuldioxid (CO2).
b) Ikke-polære kovalente binære forbindelser:I ikke-polære kovalente binære forbindelser er elektronerne delt ligeligt mellem atomerne. Fraværet af en signifikant forskel i elektronegativitet resulterer i en ikke-polær binding. Eksempler omfatter oxygengas (O2) og nitrogengas (N2).
Klassificeringen af binære forbindelser som ionisk eller kovalent er ikke altid entydig, og der kan være mellemliggende tilfælde med varierende grader af ionisk karakter eller kovalent karakter. Elektronegativiteten af de indgående atomer og typen af involveret kemisk binding bestemmer arten af den binære forbindelse.
Sidste artikelHvilke typer ionforbindelser findes der?
Næste artikelHvilke grundstoffer er der i ionforbindelser?
 Varme artikler
Varme artikler
-
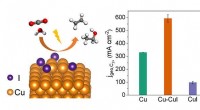 Ny katalysator øger kuldioxid elektroreduktion til multicarbon-produkterEn Cu-CuI-kompositkatalysator opnår højeffektiv produktion af C 2 + kemikalier fra elektrokatalytisk CO 2 reduktion. Kredit:LI Hefei og LIU Tianfu Elektrokatalytisk CO 2 reduktionsreaktion
Ny katalysator øger kuldioxid elektroreduktion til multicarbon-produkterEn Cu-CuI-kompositkatalysator opnår højeffektiv produktion af C 2 + kemikalier fra elektrokatalytisk CO 2 reduktion. Kredit:LI Hefei og LIU Tianfu Elektrokatalytisk CO 2 reduktionsreaktion -
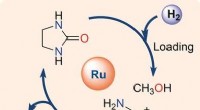 Kemisk brintlagringssystemKredit:Wiley Brint er en yderst attraktiv, men også stærkt eksplosiv energibærer, som kræver sikker, let og billig opbevaring samt transportsystemer. Forskere ved Weizmann Institute of Science, Is
Kemisk brintlagringssystemKredit:Wiley Brint er en yderst attraktiv, men også stærkt eksplosiv energibærer, som kræver sikker, let og billig opbevaring samt transportsystemer. Forskere ved Weizmann Institute of Science, Is -
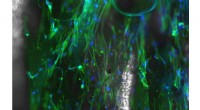 Ingeniører laver den grundlæggende byggesten til elektrospundne nanofibreSelvom polymermaterialets tekstur er synlig for det blotte øje, mikroskopiske billeder afslører forviklingen af lommer og tråde i strukturen. Kredit:Smitha Rao/Michigan Tech Elektrospinning brug
Ingeniører laver den grundlæggende byggesten til elektrospundne nanofibreSelvom polymermaterialets tekstur er synlig for det blotte øje, mikroskopiske billeder afslører forviklingen af lommer og tråde i strukturen. Kredit:Smitha Rao/Michigan Tech Elektrospinning brug -
 On-demand glas er lige rundt om hjørnetSEM af Silica bruges til at fremstille de kolloide glas. Kredit:GiulioMonaco UniTrento En forskergruppe koordineret af fysikere fra University of Trento var i stand til at undersøge intern stress
On-demand glas er lige rundt om hjørnetSEM af Silica bruges til at fremstille de kolloide glas. Kredit:GiulioMonaco UniTrento En forskergruppe koordineret af fysikere fra University of Trento var i stand til at undersøge intern stress
- Ny banansygdom breder sig og udgør en trussel mod Afrikas fødevaresikkerhed
- Undersøgelse finder strategier til at tilskynde til 50 procent skatterestitution
- Introduktion til Zero Energy Homes
- Forskere viser, at chirale oxidkatalysatorer justerer elektronspin
- Glasglas, der kan revolutionere fluorescensmikroskopi
- Hvad forudsiger bedst vold i Richmond-kvarterer? Uagtsomme udlejere


