Hvilke typer ionforbindelser findes der?
1. Binære ioniske forbindelser:
- Disse forbindelser er sammensat af to forskellige typer ioner, en positiv (kation) og en negativ (anion).
- Eksempler omfatter natriumchlorid (NaCl) og kaliumiodid (KI).
2. Polyatomiske ioniske forbindelser:
- Disse forbindelser indeholder mindst én polyatomisk ion, som er en ion sammensat af flere atomer, der er kovalent bundet sammen og bærer en samlet ladning.
- Eksempler omfatter ammoniumsulfat ((NH4)2SO4) og natriumcarbonat (Na2CO3).
3. Hydrerede ioniske forbindelser:
- Disse forbindelser indeholder vandmolekyler knyttet til ionerne, der danner hydratiserede ioner eller koordinationskomplekser.
- Eksempler omfatter kobbersulfatpentahydrat (CuSO4·5H2O) og natriumthiosulfatpentahydrat (Na2S2O3·5H2O).
4. Dobbeltsalte:
- Disse forbindelser indeholder to forskellige kationer eller anioner kombineret i et enkelt krystalgitter.
- Eksempler omfatter kaliumnatriumtartrat (KNaC4H4O6·4H2O) og ammoniumferrosulfat (NH4Fe(SO4)2·6H2O).
5. Grundlæggende salte:
- Disse forbindelser indeholder både hydroxylioner (OH-) og andre anioner.
- Eksempler omfatter kobberhydroxidcarbonat (Cu2(OH)2CO3) og magnesiumhydroxidchlorid (Mg(OH)Cl).
6. Syresalte:
- Disse forbindelser indeholder både hydrogenioner (H+) og andre kationer.
- Eksempler omfatter kaliumhydrogensulfat (KHSO4) og natriumhydrogencarbonat (NaHCO3).
7. Komplekse salte:
- Disse forbindelser indeholder en metalion bundet til en kompleks ion, som er en polyatomisk ion med et centralt metalatom omgivet af ligander (normalt anioner eller neutrale molekyler).
- Eksempler omfatter kaliumhexacyanoferrat(III) (K3[Fe(CN)6]) og natriumnitroprussid (Na2[Fe(CN)5NO]·2H2O).
Disse er nogle almindelige typer af ioniske forbindelser, men der kan være variationer og yderligere klassifikationer afhængigt af forbindelsernes specifikke egenskaber og strukturer.
Sidste artikelHvad har alle forbindelser til fælles?
Næste artikelHvad er de to typer binære forbindelser?
 Varme artikler
Varme artikler
-
 Ny polymer kan øge ydeevnen af organiske og perovskit-solcellerVariation på forsiden af Macromolecular Chemistry and Physics-udgaven med undersøgelsen rapporteret i denne historie, begge kunstværker af undersøgelsens første forfatter. Kredit:Marina Tepliakova/S
Ny polymer kan øge ydeevnen af organiske og perovskit-solcellerVariation på forsiden af Macromolecular Chemistry and Physics-udgaven med undersøgelsen rapporteret i denne historie, begge kunstværker af undersøgelsens første forfatter. Kredit:Marina Tepliakova/S -
 Forskningsteam afdækker ekstraordinære egenskaber ved strontiumniobatForskere ledet af professor T Venky Venkatesan (første række, centrum), Direktør for NUSNNI, afdækkede ekstraordinære egenskaber ved halvledermateriale strontiumniobat. Kredit:National University of S
Forskningsteam afdækker ekstraordinære egenskaber ved strontiumniobatForskere ledet af professor T Venky Venkatesan (første række, centrum), Direktør for NUSNNI, afdækkede ekstraordinære egenskaber ved halvledermateriale strontiumniobat. Kredit:National University of S -
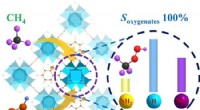 Forskere foreslår ny strategi for at forbedre metanhydroxyleringUiO-66-X-katalysatoren omdanner CH4 direkte til oxygenater med 100 % selektivitet ved at bruge H2O2 som oxidationsmiddel. Kredit:Fang Geqian Metan, hovedsageligt fra naturgas, skifergas og metanhyd
Forskere foreslår ny strategi for at forbedre metanhydroxyleringUiO-66-X-katalysatoren omdanner CH4 direkte til oxygenater med 100 % selektivitet ved at bruge H2O2 som oxidationsmiddel. Kredit:Fang Geqian Metan, hovedsageligt fra naturgas, skifergas og metanhyd -
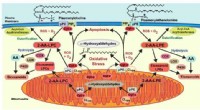 Hvad sker der med plasmalogener, fosfolipiderne ingen kan lide at tænke påDiagram viser signalveje påvirket af cytochrom cs nedbrydning af plasmalogen. Kredit:Richard Gross Patienter med Alzheimers sygdom mister op til 60 % af en komponent kaldet plasmalogen fra membran
Hvad sker der med plasmalogener, fosfolipiderne ingen kan lide at tænke påDiagram viser signalveje påvirket af cytochrom cs nedbrydning af plasmalogen. Kredit:Richard Gross Patienter med Alzheimers sygdom mister op til 60 % af en komponent kaldet plasmalogen fra membran
- Kan man eje en elbil uden en hjemmeoplader?
- Retfærdig sammenligning af afsaltningsteknologier sætter varme på energikilder
- Polaris Star:Sådan får du øje på nordstjernen på nattehimlen
- NIF fusion breakeven krav peer reviewed og verificeret af flere teams
- Hvad er trinene til at adskille svovljern og sukker?
- Hvad skete der med vores lovede fritid? Og finder vi det i den smarte by?


