Hvordan bestemmes massen af 1 mol et grundstof?
1. Isotopisk overflod:Grundstoffer eksisterer som forskellige isotoper, med variationer i antallet af neutroner i deres atomkerner. Hver isotop har en specifik masse forbundet med sig. For at bestemme molmassen skal vi tage højde for den isotopiske sammensætning og den relative mængde af grundstoffet.
2. Massespektrometri:Denne analytiske teknik spiller en afgørende rolle ved bestemmelse af den isotopiske sammensætning af et grundstof. Massespektrometri adskiller ioner baseret på deres masse-til-ladning-forhold, hvilket muliggør identifikation og kvantificering af forskellige isotoper. Ved at måle masserne og de relative intensiteter af isotoptoppe kan forskerne beregne den gennemsnitlige atommasse af grundstoffet.
3. Avogadros tal:Avogadros tal (Nₐ) repræsenterer antallet af partikler (atomer, molekyler eller ioner), der er til stede i et mol af et stof. Den har en fast værdi på cirka 6,02214076 × 10^23 partikler pr. mol.
4. Molmasseberegning:Når den gennemsnitlige atommasse er bestemt, kan molmassen beregnes ved at gange den gennemsnitlige atommasse med Avogadros tal. Dette giver massen af 1 mol af grundstoffet i gram.
For eksempel, hvis vi betragter kulstof som et grundstof:
- Kulstof har tre naturligt forekommende isotoper:kulstof-12 (¹²C), kulstof-13 (¹³C) og kulstof-14 (¹⁴C).
- Ved hjælp af massespektrometri bestemmes de isotopiske mængder:¹²C ~ 98,93%, ¹³C ~ 1,07% og ¹⁴C ~ spormængder.
- Den gennemsnitlige atommasse af kulstof beregnes ud fra de isotopiske mængder og deres respektive masser:
Atommasse =(98,93% × 12,0000 amu) + (1,07% × 13,0034 amu) + (spor% × 14,0032 amu) ≈ 12,011 amu
- Multiplicering af den gennemsnitlige atommasse med Avogadros tal (6,02214076 × 10^23 partikler/mol) giver den molære masse:
Molær masse =12,011 amu/atom × 6,02214076 × 10^23 atomer/mol ≈ 12,011 g/mol
Derfor er massen af 1 mol kulstof cirka 12,011 gram.
Denne proces kan anvendes til at bestemme molmassen af ethvert element under hensyntagen til dets isotopsammensætning og ved hjælp af nøjagtige teknikker såsom massespektrometri. Molær masse er en grundlæggende egenskab, der bruges i forskellige kemiske beregninger, herunder støkiometri og bestemmelse af mængden af stof i kemiske reaktioner.
Sidste artikelHvorfor er lithium og beryllium kovalente i naturen?
Næste artikelHvad er denne empiriske formel - C5H8NO4?
 Varme artikler
Varme artikler
-
 Sensor kan hjælpe patienter med at holde styr på deres medicinEn lillebitte, berøringsbaseret sensor bruger sved til at registrere niveauet af lithium i kroppen. Kredit:Jialun Zhu og Shuyu Lin Lithium kan lindre symptomerne på bipolar lidelse og depression -
Sensor kan hjælpe patienter med at holde styr på deres medicinEn lillebitte, berøringsbaseret sensor bruger sved til at registrere niveauet af lithium i kroppen. Kredit:Jialun Zhu og Shuyu Lin Lithium kan lindre symptomerne på bipolar lidelse og depression - -
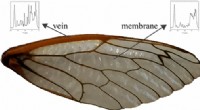 Hvordan cikader formår at vinge denKredit:American Chemical Society I modsætning til græshopper og mange andre flyvende insekter, Cikader svæver ikke gennem luften med den største lethed. Nu i en undersøgelse, der viser ACS Journa
Hvordan cikader formår at vinge denKredit:American Chemical Society I modsætning til græshopper og mange andre flyvende insekter, Cikader svæver ikke gennem luften med den største lethed. Nu i en undersøgelse, der viser ACS Journa -
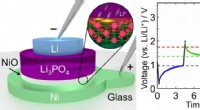 Lille, hurtig, og meget energieffektiv hukommelsesenhed inspireret af lithium-ion-batterierDe stablede lag i den foreslåede hukommelsesenhed danner et minibatteri, der hurtigt og effektivt kan skiftes mellem tre forskellige spændingstilstande (0,95 V, 1,35 V, og 1,80 V). Kredit:ACS Applied
Lille, hurtig, og meget energieffektiv hukommelsesenhed inspireret af lithium-ion-batterierDe stablede lag i den foreslåede hukommelsesenhed danner et minibatteri, der hurtigt og effektivt kan skiftes mellem tre forskellige spændingstilstande (0,95 V, 1,35 V, og 1,80 V). Kredit:ACS Applied -
 Løsning af plastikmanglen med en ny kemisk katalysatorKredit:CC0 Public Domain I et år, der allerede har ramt produktionsforsyningskæder, endnu en mangel komplicerer producenters og forbrugeres liv:plastik, og fødevareemballagen, bilkomponenter, tøj,
Løsning af plastikmanglen med en ny kemisk katalysatorKredit:CC0 Public Domain I et år, der allerede har ramt produktionsforsyningskæder, endnu en mangel komplicerer producenters og forbrugeres liv:plastik, og fødevareemballagen, bilkomponenter, tøj,
- Forskere lægger grunden til en pålidelig marihuana -alkometer
- Rusland vil tilbage til Venus, bygge genbrugelig raket
- Undersøgelse viser, at sociale medier er et effektivt redskab til at forudsige afstemningsresultate…
- Ikke-lineær strålerensning i spatiotemporally mode-locked lasere
- Elektrisk manipulation af magnetiske partikler muliggør stor højhastighedshukommelse
- Kan du ikke konkurrere på møg? Prøv at parre æblepresser


