Hvad er tommelfingerreglen for at bestemme antallet af kovalente bindinger et atom kan udføre?
Der er nogle undtagelser fra denne tommelfingerregel. For eksempel kan brint kun danne én kovalent binding, selvom den har én valenselektron. Dette skyldes, at brint kun har én elektronskal, og elektronen i denne skal ikke deles med noget andet atom. Nogle atomer kan også danne flere kovalente bindinger, end de har valenselektroner ved at bruge deres d-orbitaler. Dette kaldes "hybridisering". For eksempel kan kulstof danne fire kovalente bindinger ved hjælp af dets fire valenselektroner, men det kan også danne fem kovalente bindinger ved at bruge dets d-orbitaler.
Sidste artikelVil salicylsyre opløses i citrat?
Næste artikelHvad er pka af en carboxylsyre?
 Varme artikler
Varme artikler
-
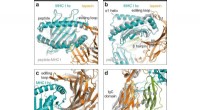 Molekylære chaperoninteraktioner visualiseret gennem røntgenstrukturanalyseKonformationelle ændringer ved klient-chaperone engagement. et topbillede af superpositionering af peptid-receptiv MHC I i chaperonkomplekset (MHC I hc, teal; tapasin, orange) med peptidbundet H2-Db (
Molekylære chaperoninteraktioner visualiseret gennem røntgenstrukturanalyseKonformationelle ændringer ved klient-chaperone engagement. et topbillede af superpositionering af peptid-receptiv MHC I i chaperonkomplekset (MHC I hc, teal; tapasin, orange) med peptidbundet H2-Db ( -
 Atomisk tynde perovskites booster til fremtidig elektronikKredit:National Institute for Materials Science WPI-MANA har udviklet verdens højeste ydeevne dielektriske nanofilm ved hjælp af atomisk tynde perovskiter. Denne teknologi kan revolutionere næst
Atomisk tynde perovskites booster til fremtidig elektronikKredit:National Institute for Materials Science WPI-MANA har udviklet verdens højeste ydeevne dielektriske nanofilm ved hjælp af atomisk tynde perovskiter. Denne teknologi kan revolutionere næst -
 Dyrkning af HCA -krystallerKredit:ESS/Fisher Zoë Fisher og Katarina Koruza fra ESS Deuteration and Macromolecular Crystallization (DEMAX) Support lab og Lunds Universitet har brugt dampdiffusionsmetoder til at dyrke store p
Dyrkning af HCA -krystallerKredit:ESS/Fisher Zoë Fisher og Katarina Koruza fra ESS Deuteration and Macromolecular Crystallization (DEMAX) Support lab og Lunds Universitet har brugt dampdiffusionsmetoder til at dyrke store p -
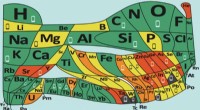 Periodisk system:ny version advarer om elementer, der er truetMenstruationssmerter. Kredit:European Chemical Society Det er fantastisk at tænke på, at alt omkring os består af kun 90 byggesten - de naturligt forekommende kemiske elementer. Dmitri Mendeleev s
Periodisk system:ny version advarer om elementer, der er truetMenstruationssmerter. Kredit:European Chemical Society Det er fantastisk at tænke på, at alt omkring os består af kun 90 byggesten - de naturligt forekommende kemiske elementer. Dmitri Mendeleev s
- EU taber bud på at omstøde WTO's Airbus-kendelse
- Bruger 60 % mindre vand i papirproduktion
- Hard computing problem kan muligvis kun løses af kvantecomputere
- Et blomstrende elbilsalg driver lithiumrush i Portugal
- Hvad driver dannelsen af sprækker, når tektoniske plader trækker fra hinanden?
- NASA forklarer, hvorfor 30. juni får ekstra sekund


