Hvor mange gram h2o og c3h6 kan der dannes ud fra 6 c3h8o?
2C3H8O + 9O2 -> 6CO2 + 8H2O
Ud fra den afbalancerede kemiske ligning kan vi se, at for hver 2 mol C3H8O, der reagerer, produceres der 8 mol H2O. Derfor vil 6 mol C3H8O producere 6 * 8 =48 mol H2O.
Den molære masse af H2O er 18 g/mol. Derfor vil 48 mol H2O have en masse på 48 * 18 =864 g.
Den afbalancerede kemiske ligning viser også, at for hver 2 mol C3H8O, der reagerer, produceres der 6 mol CO2. Derfor vil 6 mol C3H8O producere 6 * 3 =18 mol CO2.
Den molære masse af CO2 er 44 g/mol. Derfor vil 18 mol CO2 have en masse på 18 * 44 =792 g.
Derfor vil forbrændingen af 6 mol C3H8O producere 864 g H2O og 792 g CO2.
 Varme artikler
Varme artikler
-
 Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjertecellerAt afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerte
Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjertecellerAt afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerte -
 Forskere viser rolle for cyanid i livets oprindelseTodd introducerer et stykke papir til en afstembar UV -lampe for at lokalisere strålen. Kredit:Harvard University Det lyder underligt, men cyanid kan have været en vigtig ingrediens i livets oprin
Forskere viser rolle for cyanid i livets oprindelseTodd introducerer et stykke papir til en afstembar UV -lampe for at lokalisere strålen. Kredit:Harvard University Det lyder underligt, men cyanid kan have været en vigtig ingrediens i livets oprin -
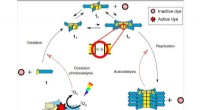 Livsemulerende molekyler viser grundlæggende stofskifteArbejdet fra Otto-lab har resulteret i et kemisk system, der viser forskellige egenskaber ved livet. Gennem oxidation, grundlæggende byggeklodser samles for at danne ringe i forskellige størrelser (ve
Livsemulerende molekyler viser grundlæggende stofskifteArbejdet fra Otto-lab har resulteret i et kemisk system, der viser forskellige egenskaber ved livet. Gennem oxidation, grundlæggende byggeklodser samles for at danne ringe i forskellige størrelser (ve -
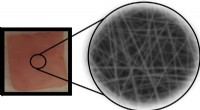 Implanterbar piezoelektrisk polymer forbedrer kontrolleret frigivelse af lægemidlerEn implanterbar piezoelektrisk polymer nanofiber -enhed, der frigiver kontrollerede mængder af et lægemiddel under mekanisk kraft. Kredit:Jin Nam/UCR En membran lavet af tråde af en polymer, der a
Implanterbar piezoelektrisk polymer forbedrer kontrolleret frigivelse af lægemidlerEn implanterbar piezoelektrisk polymer nanofiber -enhed, der frigiver kontrollerede mængder af et lægemiddel under mekanisk kraft. Kredit:Jin Nam/UCR En membran lavet af tråde af en polymer, der a
- Der er fundet beviser på, at Kuroshio-strømstyrken er blevet styrket på grund af tiltagende tropi…
- Grav af den tidlige klassiske Maya -hersker fundet i Guatemala
- Virksomheder med flere finansielle analytikere producerer flere patenter af bedre kvalitet
- Hvordan lockdown ændrede vores sexliv, ifølge ny forskning
- Astronomer kortlægger et stort tomrum i vores kosmiske kvarter
- Bogen udforsker, hvordan teknologi har transformeret læring på arbejdspladsen


