6 måder at forstyrre en kemisk ligevægt?
2. Ændring af temperaturen. Dette vil påvirke hastigheden af de fremadrettede og omvendte reaktioner og vil derfor flytte ligevægtspositionen i retning af reaktionen, der er eksoterm. Hvis du for eksempel øger temperaturen i et system, vil ligevægten skifte i retning af reaktionen, der frigiver varme. Hvis du sænker temperaturen, vil ligevægten skifte i retning af reaktionen, der absorberer varme.
3. Ændring af trykket. Dette vil kun påvirke ligevægtspositionen af en reaktion, hvis den involverer en ændring i antallet af mol gas. For eksempel, hvis du øger trykket i et system, der indeholder en gasformig reaktant, vil ligevægten skifte i retning af reaktionen, der producerer færre mol gas. Hvis du sænker trykket, vil ligevægten skifte i retning af reaktionen, der producerer flere mol gas.
4. Tilføjelse af en katalysator. En katalysator fremskynder hastigheden af en reaktion uden at blive forbrugt i reaktionen. Dette vil flytte ligevægtspositionen i retning af produkterne.
5. Udskiftning af opløsningsmidlet. Dette kan påvirke opløseligheden af reaktanterne og produkterne og kan derfor flytte ligevægtspositionen. For eksempel, hvis du ændrer opløsningsmidlet fra vand til et upolært opløsningsmiddel, vil ligevægten skifte i retning af reaktionen, der producerer flere upolære produkter.
6. Anvendelse af et elektrisk felt. Dette kan påvirke ligevægtspositionen af en reaktion, hvis den involverer ladede arter. For eksempel, hvis du anvender et elektrisk felt på et system, der indeholder en positivt ladet reaktant og et negativt ladet produkt, vil ligevægten skifte i retning af reaktionen, der producerer flere positivt ladede produkter. Fjerner man det elektriske felt, vil ligevægten skifte i retning af reaktionen, der producerer flere negativt ladede produkter.
 Varme artikler
Varme artikler
-
 Forskere afslører metode til at omdanne metangas til flydende methanolOmdannelsen fandt sted under omgivende temperatur- og trykforhold, hvilket kunne gøre det muligt at bruge metan, en potent drivhusgas, til at producere brændstof. Kredit:UFSCAR Det er lykkedes en g
Forskere afslører metode til at omdanne metangas til flydende methanolOmdannelsen fandt sted under omgivende temperatur- og trykforhold, hvilket kunne gøre det muligt at bruge metan, en potent drivhusgas, til at producere brændstof. Kredit:UFSCAR Det er lykkedes en g -
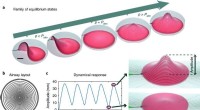 Ved at kombinere pneumatik med en hydrogel for at skabe en baromorf - til blød robotteknologien, Kontinuerlig familie af ligevægtstilstande opnået for en baromorf under forskellige tryk. b, Tilsvarende netværk af kanaler indlejret i pladen. Kanaler er mere koncentrerede i den centrale region
Ved at kombinere pneumatik med en hydrogel for at skabe en baromorf - til blød robotteknologien, Kontinuerlig familie af ligevægtstilstande opnået for en baromorf under forskellige tryk. b, Tilsvarende netværk af kanaler indlejret i pladen. Kanaler er mere koncentrerede i den centrale region -
 Accelererende udvikling af STT-MRAMKredit:Tohoku University Forskere ved Center for Innovative Integrated Electronic Systems (CIES) ved Tohoku University har med succes observeret mikroskopiske kemiske bindingstilstande i ultratynd
Accelererende udvikling af STT-MRAMKredit:Tohoku University Forskere ved Center for Innovative Integrated Electronic Systems (CIES) ved Tohoku University har med succes observeret mikroskopiske kemiske bindingstilstande i ultratynd -
 Siger mod at forbedre fælles forbindelsesteknologier til letvægts- og højstyrkestrukturerTynd GFRP forstærkning. Kredit:Toyohashi University of Technology. Forskerholdet (ledet af professor Yukihiro Matsumoto) dannet af Institut for Arkitektur og Bygningsteknik ved Toyohashi University
Siger mod at forbedre fælles forbindelsesteknologier til letvægts- og højstyrkestrukturerTynd GFRP forstærkning. Kredit:Toyohashi University of Technology. Forskerholdet (ledet af professor Yukihiro Matsumoto) dannet af Institut for Arkitektur og Bygningsteknik ved Toyohashi University
- Under pres fra Kina, Apple trækker Hong Kong protest-app
- Forskere skaber hurtigere, mere følsom fotodetektor ved at narre grafen
- Maskinindlæring afslører nye kandidatmaterialer til biokompatibel elektronik
- Program, der studerer Lake Champlain, kvalificerer sig til op til $ 1 mio
- Undersøgelse forbinder historiske boligforskelle med farlige klimapåvirkninger
- Når ok ikke er ok:Sikkerhedspræsentant taler om syntetiske klik


