Hvorfor skal en kemisk reaktion afbalanceres, før den kan bruges i støkiometri?
1. Bevarelse af masse:Støkiometriske beregninger bygger på princippet om bevarelse af masse, som siger, at den samlede masse af reaktanterne skal svare til den samlede masse af produkterne i en kemisk reaktion. Afbalancering af reaktionen sikrer, at antallet af atomer i hvert grundstof er det samme på begge sider af ligningen, hvilket opfylder dette princip.
2. Nøjagtige molforhold:Støkiometri involverer bestemmelse af det kvantitative forhold mellem reaktanter og produkter baseret på deres molforhold. En afbalanceret kemisk ligning giver de korrekte molforhold, der er nødvendige for disse beregninger. Uden en afbalanceret ligning ville molforholdene være forkerte, hvilket fører til unøjagtige støkiometriske beregninger.
3. Forudsigelse af reaktionsresultater:En afbalanceret kemisk ligning gør det muligt for kemikere at forudsige de støkiometrisk korrekte mængder af reaktanter, der kræves for at producere en specifik mængde produkt. Det hjælper med at bestemme den begrænsende reaktant og forudsige det maksimale udbytte af reaktionen.
4. Forståelse af reaktionsstøkiometri:Balancering af en kemisk reaktion afslører reaktionens støkiometri, som er det numeriske forhold mellem reaktanterne og produkterne. Det giver indsigt i de relative mængder af reaktanter og produkter involveret i reaktionen.
5. Konsistens i beregninger:Støkiometriberegninger er baseret på koefficienterne i den afbalancerede kemiske ligning. Disse koefficienter repræsenterer det relative antal mol af hvert stof involveret i reaktionen. Uden en afbalanceret ligning ville koefficienterne være forkerte, hvilket fører til uoverensstemmelser og fejl i beregningerne.
Ved at afbalancere en kemisk reaktion sikrer kemikere, at de grundlæggende principper for bevarelse af masse og molforhold overholdes. Dette muliggør nøjagtige støkiometriske beregninger, forudsigelser af reaktionsresultater og en omfattende forståelse af reaktionens støkiometri.
Sidste artikelHvad er det modsatte af krystallisation?
Næste artikel6 måder at forstyrre en kemisk ligevægt?
 Varme artikler
Varme artikler
-
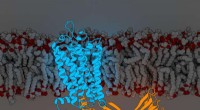 Virkninger af et stort lægemiddelmål reguleret gennem molekylære koderRhodopsinarrestin. Kredit:Parker de Waal, Xu Laboratory, Van Andel Research Institute Et hold med Van Andel Research Institute-forskere i spidsen har besvaret et mangeårigt spørgsmål, der kan føre
Virkninger af et stort lægemiddelmål reguleret gennem molekylære koderRhodopsinarrestin. Kredit:Parker de Waal, Xu Laboratory, Van Andel Research Institute Et hold med Van Andel Research Institute-forskere i spidsen har besvaret et mangeårigt spørgsmål, der kan føre -
 Forskere laver ny opskrift på kringleformede peptiderDr. Christoph Nitsche. Kredit:Australian National University Forskere fra The Australian National University (ANU) har udviklet en ny måde at syntetisere bicykliske peptider på, med store konsekven
Forskere laver ny opskrift på kringleformede peptiderDr. Christoph Nitsche. Kredit:Australian National University Forskere fra The Australian National University (ANU) har udviklet en ny måde at syntetisere bicykliske peptider på, med store konsekven -
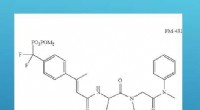 David vs Goliath:Hvordan et lille molekyle kan besejre astmaanfaldKemisk struktur af lille molekyle PM-43I. Kredit:D. Corry. En usynlig partikel kommer ind i dine lunger. Det næste, du ved, bliver det svært at trække vejret. Du har et astmaanfald. Astma er en af
David vs Goliath:Hvordan et lille molekyle kan besejre astmaanfaldKemisk struktur af lille molekyle PM-43I. Kredit:D. Corry. En usynlig partikel kommer ind i dine lunger. Det næste, du ved, bliver det svært at trække vejret. Du har et astmaanfald. Astma er en af -
 Ny 3D-røntgenteknik afslører hemmeligheder inde i knoglerneKredit:Tilman Grünewald Et internationalt forskerhold har brugt nye røntgenteknikker til at beskrive, hvordan arkitekturen i sunde menneskelige knogler er bygget op. Holdet har afdækket en hidtil
Ny 3D-røntgenteknik afslører hemmeligheder inde i knoglerneKredit:Tilman Grünewald Et internationalt forskerhold har brugt nye røntgenteknikker til at beskrive, hvordan arkitekturen i sunde menneskelige knogler er bygget op. Holdet har afdækket en hidtil
- Hvad giver vaskulært væv til planter?
- Et frastødende materiale:Nye hydrogelegenskaber domineret af elektrostatisk frastødning
- Astronomer udfører den hidtil største undersøgelse af højmasse dobbeltstjernesystemer
- Innovativ silicium nanochip kan omprogrammere biologisk væv i levende krop
- Er CCl4 en ionisk eller kovalent?
- Sådan studeres tidstabeller


