Hvad er en dobbelt kovalent binding, og hvad sker der i den?
Overlapning af atomorbitaler:
Den dobbelte kovalente binding dannes, når to atomare orbitaler fra forskellige atomer overlapper betydeligt. Disse atomare orbitaler skal have passende symmetri og energiniveauer for at muliggøre effektiv overlapning.
Elektronparring:
Hvert atom bidrager med to elektroner, der optager de overlappende atomorbitaler. Disse fire elektroner parrer sig derefter og optager to molekylære orbitaler dannet af kombinationen af de oprindelige atomare orbitaler.
Dannelse af Sigma- og Pi-obligationer:
I en dobbelt kovalent binding danner et af elektronparrene en sigma (σ) binding, som er dannet ved frontal overlapning af atomare orbitaler, hvilket resulterer i en stærk aksial binding mellem de to atomer. Det andet elektronpar danner en pi (π)-binding, som dannes af sideværts overlapning af atomare orbitaler, hvilket skaber en svagere binding over og under sigma-bindingen.
Elektron delokalisering:
Elektronerne i en dobbelt kovalent binding er delokaliseret, hvilket betyder, at de ikke er begrænset til et specifikt område mellem de to atomer. I stedet er de spredt ud og skaber en elektronsky, der omfatter begge atomer.
Bindingsstyrke:
En dobbelt kovalent binding er stærkere end en enkelt kovalent binding, fordi der er fire elektroner delt i stedet for to. Den større elektrontæthed mellem atomerne fører til øget bindingsstyrke og stabilitet.
Eksempler på dobbeltkovalente bindinger:
Nogle almindelige eksempler på molekyler med dobbeltkovalente bindinger omfatter:
Ethylen (C2H4):Hvert carbonatom bidrager med to elektroner til at danne en dobbelt kovalent binding mellem de to carbonatomer.
Kuldioxid (CO2):Hvert oxygenatom bidrager med to elektroner til at danne dobbeltkovalente bindinger med det centrale kulstofatom.
Ethen (C2H4):Hvert carbonatom deler to elektroner i en dobbelt kovalent binding, der danner en carbon-carbon dobbeltbinding.
Implikationer i molekylær struktur og egenskaber:
Tilstedeværelsen af dobbeltkovalente bindinger påvirker i væsentlig grad forbindelsernes molekylære struktur og egenskaber. Dobbeltbindinger involverer typisk kortere bindingslængder, øget bindingsstyrke og begrænset rotation omkring bindingsaksen sammenlignet med enkeltbindinger. Disse faktorer bidrager til den overordnede stabilitet, geometri og reaktivitet af molekyler, der indeholder dobbeltkovalente bindinger.
Samlet set er en dobbelt kovalent binding et afgørende begreb i kemi, da det forklarer deling af fire elektroner mellem to atomer, hvilket fører til stærkere bindinger og påvirker forskellige molekylers egenskaber og adfærd.
 Varme artikler
Varme artikler
-
 Ny metode fremskynder udviklingen af medicinI laboratoriet hos Bernhard Spingler (r.), praktikant Philipp Nievergelt (l.) ydede et vigtigt bidrag til hurtigere og lettere at bestemme krystalstrukturerne af organiske salte. Kredit:UZH Forske
Ny metode fremskynder udviklingen af medicinI laboratoriet hos Bernhard Spingler (r.), praktikant Philipp Nievergelt (l.) ydede et vigtigt bidrag til hurtigere og lettere at bestemme krystalstrukturerne af organiske salte. Kredit:UZH Forske -
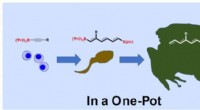 Forskere udvikler kemisk reaktionsmetode til mere effektiv lægemiddelproduktionLigesom en paddes udvikling, molekyler kan omdannes til polyenunderstrukturer, der er byggesten, der er nødvendige for antibiotika og kræftbehandlingsmidler. Kredit:Masafumi Hirano. TUAT Forskere
Forskere udvikler kemisk reaktionsmetode til mere effektiv lægemiddelproduktionLigesom en paddes udvikling, molekyler kan omdannes til polyenunderstrukturer, der er byggesten, der er nødvendige for antibiotika og kræftbehandlingsmidler. Kredit:Masafumi Hirano. TUAT Forskere -
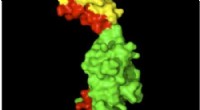 Nyt forskningsområde:Hvordan proteinstrukturer ændrer sig på grund af normale kræfterStrukturen af myomesin med elastiske områder vist med rødt. Kredit:Matthias Wilmanns Proteiner fremstillet i vores celler foldes i bestemte former, så de kan opfylde deres funktioner. Forskere h
Nyt forskningsområde:Hvordan proteinstrukturer ændrer sig på grund af normale kræfterStrukturen af myomesin med elastiske områder vist med rødt. Kredit:Matthias Wilmanns Proteiner fremstillet i vores celler foldes i bestemte former, så de kan opfylde deres funktioner. Forskere h -
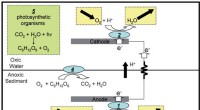 NRL udstedt patent for solar mikrobiel brændselscelleSkematisk skildring af forenklet mekanisme til energiproduktion af den bentiske mikrobielle brændselscelle (BMFC), uden boks mærket 5 svarende til fotosyntese, og for den mikrobielle fotoelektrokemisk
NRL udstedt patent for solar mikrobiel brændselscelleSkematisk skildring af forenklet mekanisme til energiproduktion af den bentiske mikrobielle brændselscelle (BMFC), uden boks mærket 5 svarende til fotosyntese, og for den mikrobielle fotoelektrokemisk
- Moss:En biomonitor af atmosfærisk nitrogenaflejring i Yangtze-flodens delta
- Forskere undersøger mikroplastik i drikkevand
- Da Mendeleyev ændrede layoutet, var der gapshow, hjalp graps videnskabsmænd på udkig efter uopdag…
- Jævn og stabil opladning af elbiler
- Undersøgelse undersøger bemærkelsesværdig negativ termisk ekspansion set i lagdelte ruthenater
- Hvor er en snedækket ugle på en madweb?


