Hvorfor leder kaliumchlorid elektricitet i fast tilstand, men er en god leder-smeltet tilstand?
I fast KCl holdes ionerne sammen af stærke elektrostatiske kræfter. Disse kræfter forhindrer ionerne i at bevæge sig, så forbindelsen kan ikke lede elektricitet. Når KCl er opløst i vand, omgiver vandmolekylerne ionerne og bryder de elektrostatiske kræfter fra hinanden. Dette gør det muligt for ionerne at bevæge sig frit, og forbindelsen bliver en god leder af elektricitet.
Det samme sker, når KCl smeltes. Varmen fra smeltningsprocessen bryder de elektrostatiske kræfter mellem ionerne fra hinanden, så de kan bevæge sig frit og lede elektricitet.
Forskellen i ledningsevne mellem fast og smeltet KCl skyldes forskellen i ionernes mobilitet. I fast tilstand er ionerne ubevægelige og kan ikke lede elektricitet. I smeltet tilstand er ionerne mobile og kan lede elektricitet.
 Varme artikler
Varme artikler
-
 Dyb læring giver lægemiddeldesign et løftEt beregningsværktøj skabt på Rice University kan hjælpe medicinalvirksomheder med at udvide deres evne til at undersøge lægemidlers sikkerhed. Kredit:Kavraki Lab/Rice University Når du tager medi
Dyb læring giver lægemiddeldesign et løftEt beregningsværktøj skabt på Rice University kan hjælpe medicinalvirksomheder med at udvide deres evne til at undersøge lægemidlers sikkerhed. Kredit:Kavraki Lab/Rice University Når du tager medi -
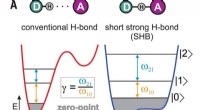 Eksperimenter med bifluoridioner viser tegn på hybridbindingerHydrogenbindinger. (A) Typer af hydrogenbindinger afhængigt af donor-acceptor afstand. Potentialer for protonbevægelse vises sammen med de tre første kvantenniveauer og de tilhørende laveste energiove
Eksperimenter med bifluoridioner viser tegn på hybridbindingerHydrogenbindinger. (A) Typer af hydrogenbindinger afhængigt af donor-acceptor afstand. Potentialer for protonbevægelse vises sammen med de tre første kvantenniveauer og de tilhørende laveste energiove -
 Lab-on-a-chip driver søgning efter nye lægemidler for at forhindre blodpropperDen biokompatible enhed indeholder de komplekse funktioner i et patologilaboratorium, i miniature. Kredit:RMIT University Et lille laboratorium på størrelse med et frimærke kan være den næste stor
Lab-on-a-chip driver søgning efter nye lægemidler for at forhindre blodpropperDen biokompatible enhed indeholder de komplekse funktioner i et patologilaboratorium, i miniature. Kredit:RMIT University Et lille laboratorium på størrelse med et frimærke kan være den næste stor -
 Ultratynde selvhelbredende polymerer skaber nye, bæredygtige vandafvisende belægningerKredit:CC0 Public Domain Forskere har fundet en måde at gøre ultratynde overfladebelægninger robuste nok til at overleve ridser og skrammer. Det nye materiale, udviklet ved at fusionere tyndfilm o
Ultratynde selvhelbredende polymerer skaber nye, bæredygtige vandafvisende belægningerKredit:CC0 Public Domain Forskere har fundet en måde at gøre ultratynde overfladebelægninger robuste nok til at overleve ridser og skrammer. Det nye materiale, udviklet ved at fusionere tyndfilm o
- Fysikere lykkes med at filme faseovergange med ekstrem høj rumlig og tidsmæssig opløsning
- Hvordan affald fra mineindustrien har foreviget apartheid-lignende politikker i Sydafrika
- Aktiv camouflage kunstig hud i området synligt for infrarødt
- Den nuværende forståelse af dyrevelfærd udelukker i øjeblikket fisk, selvom fisk føler smerte
- Sådan fungerer tårnkraner
- Infrarød vision lader forskere se igennem – og ind i – flere lag af grafen


