Hvorfor er argon monoatomisk i naturen?
I tilfælde af argon indeholder dens yderste elektronskal 8 elektroner, hvilket er det maksimale antal elektroner, som denne skal kan rumme. Denne fulde elektronskal giver argon en meget stabil konfiguration, hvilket betyder, at det er usandsynligt, at det danner kemiske bindinger med andre grundstoffer. Som et resultat findes argon som en monoatomisk gas, hvilket betyder, at den eksisterer som individuelle atomer snarere end molekyler.
De andre ædelgasser, helium, neon, krypton, xenon og radon, er også monoatomiske gasser af samme grund. De har alle fulde yderste elektronskaller, hvilket gør dem meget stabile og sandsynligvis ikke danne kemiske bindinger.
 Varme artikler
Varme artikler
-
 Planteforsvarslaget har uventet effekt på flygtige forbindelser, undersøgelse finderNatalia Dudareva og kolleger fandt ud af, at neglebåndet af petunia-blomster fungerer som en vask for flygtige forbindelser. I stedet for at udsende flere af disse forbindelser, når neglebåndet er tyn
Planteforsvarslaget har uventet effekt på flygtige forbindelser, undersøgelse finderNatalia Dudareva og kolleger fandt ud af, at neglebåndet af petunia-blomster fungerer som en vask for flygtige forbindelser. I stedet for at udsende flere af disse forbindelser, når neglebåndet er tyn -
 Clingy kobberioner bidrager til katalysatorafmatningKredit: ACS -katalyse Kraftige dieseltrucks på vejen i dag er udstyret med efterbehandlingssystemer, der inkluderer selektiv katalytisk reduktion (SCR) teknologi, der anvender urinstofopløsning s
Clingy kobberioner bidrager til katalysatorafmatningKredit: ACS -katalyse Kraftige dieseltrucks på vejen i dag er udstyret med efterbehandlingssystemer, der inkluderer selektiv katalytisk reduktion (SCR) teknologi, der anvender urinstofopløsning s -
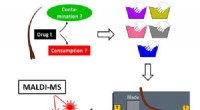 Løsning af et behåret retsmedicinsk problemKredit:American Chemical Society I årtier, retsmedicinere har testet hårstrå for at afsløre stofbrug eller forgiftning. Men i de senere år, rapporter har sat spørgsmålstegn ved teknikken - især, d
Løsning af et behåret retsmedicinsk problemKredit:American Chemical Society I årtier, retsmedicinere har testet hårstrå for at afsløre stofbrug eller forgiftning. Men i de senere år, rapporter har sat spørgsmålstegn ved teknikken - især, d -
 En selvhelende strukturel farvehydrogel inspireret af naturenEt sæt selvhelende hydrogelfilm med forskellige strukturelle farver. Kredit:Yuanjin Zhao. (Phys.org)-Et team af forskere ved Southeast University i Kina har udviklet en selvhelende strukturel hydr
En selvhelende strukturel farvehydrogel inspireret af naturenEt sæt selvhelende hydrogelfilm med forskellige strukturelle farver. Kredit:Yuanjin Zhao. (Phys.org)-Et team af forskere ved Southeast University i Kina har udviklet en selvhelende strukturel hydr
- Hvad er den minimale højde, en bold skal kastes op i luften for en lovlig serv?
- Mexico auktionerer seks af ni store olieblokke på dybt vand
- Walmart begynder temperaturtjek af arbejdere
- Forbrugerne vil betale mere for crowdfundede produkter for at øge ligheden på markedet
- Forståelse af enzymudvikling baner vejen for grøn kemi
- Sådan forklares Density


