Forståelse af enzymudvikling baner vejen for grøn kemi
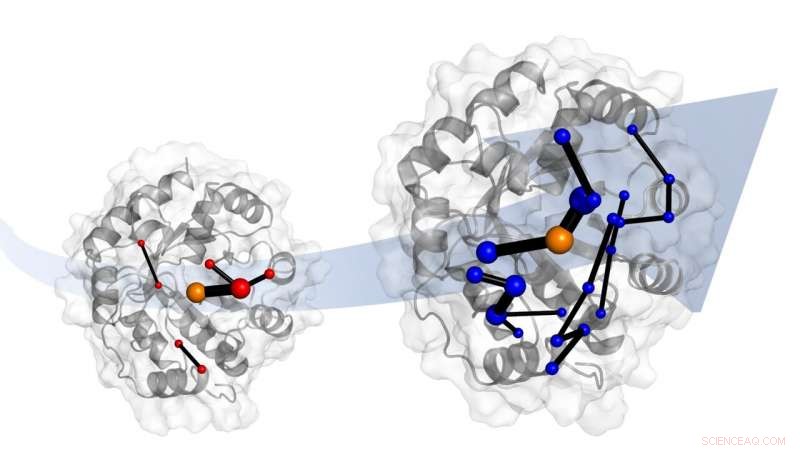
Laboratorieudvikling af et designerenzym gør det til en meget bedre katalysator. Simuleringer viser, at evolutionen gør dette ved at indføre netværk af aminosyrer. Disse netværk lover at være skabeloner til katalysatordesign. Kredit:Dr. Adrian Bunzel
Forskere ved University of Bristol har vist, hvordan laboratorie-evolution kan give anledning til højeffektive enzymer til nye-til-natur-reaktioner, åbner døren for nye og mere miljøvenlige måder at fremstille stoffer og andre kemikalier på.
Forskere har tidligere designet proteinkatalysatorer fra bunden ved hjælp af computere, men disse er meget mindre dygtige end naturlige enzymer. For at forbedre deres præstationer, en teknik kaldet laboratorieevolution kan bruges, som den amerikanske kemiingeniør Frances Arnold var pioner for, og som hun modtog Nobelprisen for i 2018. Instrueret evolution efterligner naturlig udvælgelse, giver videnskabsfolk mulighed for at bruge biologiens kraft til at forbedre proteiners evne til at udføre opgaver såsom at katalysere en specifik kemisk reaktion.
Men selvom forskerholdet for nylig havde brugt laboratorieevolution til at forbedre et designet enzym med mere end 1, 000 gange, det var ukendt, hvordan evolutionen øger sin aktivitet. Indtil nu.
Hovedforfatter professor Adrian Mulholland fra Bristol's School of Chemistry sagde:"Evolution kan gøre katalysatorer meget mere aktive. Sagen er, at evolution fungerer på mystiske måder:f.eks. mutationer, der tilsyneladende forbedrer katalyse, involverer ofte ændringer i aminosyrer langt fra det aktive sted, hvor reaktionen sker."
"Vi ønskede at forstå, hvordan evolution kan transformere ineffektive designerbiokatalysatorer til yderst aktive enzymer." undersøgelsens første forfatter, Dr. Adrian Bunzel, sagde.
For at gøre det, det internationale forskerhold fra Bristol, ETH Zürich og University of Waikato (NZ) vendte sig til molekylære computersimuleringer. "Disse viser, at evolutionen ændrer den måde, proteinet bevæger sig på - dets dynamik. Enkelt sagt, evolution 'tuner' fleksibiliteten af hele proteinet, " han tilføjede.
Holdet identificerede også netværket af aminosyrer i proteinet, der er ansvarligt for denne 'tuning'. Disse netværk involverer dele af proteinet, der ændres ved evolution.
Dr. Bunzel sagde:"Efter evolution, hele proteinet ser ud til at arbejde sammen for at fremskynde reaktionen. Dette er vigtigt, fordi når vi designer enzymer, vi fokuserer ofte kun på det aktive websted, og glem alt om resten af proteinet."
Prof Mulholland tilføjede:"Denne form for analyse kunne hjælpe med at designe mere effektive 'de novo' enzymer, for reaktioner, som vi tidligere ikke kunne målrette mod."
Forskningen, udgivet i Naturkemi , afslører, hvordan evolution gør designerenzymer mere kraftfulde, baner vejen for skræddersyede katalysatorer til grøn kemi.
Forskerne vil nu bruge deres resultater til at hjælpe med at designe nye proteinkatalysatorer.
 Varme artikler
Varme artikler
-
 Formændrende element har nøglen til antibakteriel belægningAfbildet fra venstre til højre:University of Canterbury ph.d.-studerende Rukmini Gorthy og Johann Land og forskningsleder Maskin- og materialteknik Professor Susan Krumdieck er medforfattere på et pap
Formændrende element har nøglen til antibakteriel belægningAfbildet fra venstre til højre:University of Canterbury ph.d.-studerende Rukmini Gorthy og Johann Land og forskningsleder Maskin- og materialteknik Professor Susan Krumdieck er medforfattere på et pap -
 Magnetiske tænder afsløret ved hjælp af kvantebillederAcanthopleura hirtosa chiton radula. Den fulde radula består af 73 tænder med forskellige stadier af mineralisering. Billedet ovenfor viser tænderne før og efter starten af magnetitmineralisering. D
Magnetiske tænder afsløret ved hjælp af kvantebillederAcanthopleura hirtosa chiton radula. Den fulde radula består af 73 tænder med forskellige stadier af mineralisering. Billedet ovenfor viser tænderne før og efter starten af magnetitmineralisering. D -
 Små børster, der gør overflader glatte, fungerer muligvis ikke efter hensigten, undersøgelse fin…I rent vand, disse små molekylære børster står lige op og bevarer en glat overflade. Men tilføjelse af ioner med +2 og +3 ladninger får dem til at klumpe og miste deres glathed (ovenfor). Kredit:Yu et
Små børster, der gør overflader glatte, fungerer muligvis ikke efter hensigten, undersøgelse fin…I rent vand, disse små molekylære børster står lige op og bevarer en glat overflade. Men tilføjelse af ioner med +2 og +3 ladninger får dem til at klumpe og miste deres glathed (ovenfor). Kredit:Yu et -
 Oprettelse af lithium-ion-batterier med højere energitæthed til vedvarende energianvendelserI den Journal of Vacuum Science and Technology A , forskere undersøger oprindelsen af nedbrydning i LIB-katodematerialer med høj energitæthed og udvikler strategier til at afbøde disse nedbrydning
Oprettelse af lithium-ion-batterier med højere energitæthed til vedvarende energianvendelserI den Journal of Vacuum Science and Technology A , forskere undersøger oprindelsen af nedbrydning i LIB-katodematerialer med høj energitæthed og udvikler strategier til at afbøde disse nedbrydning
- Er regnvand sikkert at drikke?
- Sådan fungerer rumregulering
- Sådan identificeres slanger i Pennsylvania <p> <p> Pennsylvania er en amerikansk stat i Mellematlan…
- Hvirvlende spiraler på Mars nordpol
- Estimering af glasovergangstemperaturen for polymerer i lukkede geometrier
- Klimaændringer kan ødelægge Doomsday Vault


