Hvordan er ioniske og kovalente bindinger forskellige fra hydrogenbindinger?
De vigtigste forskelle mellem ioniske, kovalente og hydrogenbindinger er:
* Styrke: Ionbindinger er den stærkeste type binding, efterfulgt af kovalente bindinger og derefter hydrogenbindinger.
* Retning: Ioniske og kovalente bindinger er retningsbestemte, hvilket betyder, at de har en specifik orientering i rummet. Hydrogenbindinger er ikke-retningsbestemte, hvilket betyder, at de kan dannes i alle retninger.
* Antal obligationer: Ioniske og kovalente bindinger kan kun dannes mellem to atomer, mens hydrogenbindinger kan dannes mellem flere atomer.
* Polaritet: Ioniske og kovalente bindinger er polære, hvilket betyder, at de har en positiv og negativ ende. Hydrogenbindinger er ikke-polære, hvilket betyder, at de ikke har en positiv eller negativ ende.
Følgende tabel opsummerer de vigtigste forskelle mellem ioniske, kovalente og hydrogenbindinger:
| Ejendom | Ionisk binding | Kovalent binding | Hydrogenbinding |
|---|---|---|---|
| Styrke | Stærk | Stærk | Svag |
| Retningsbestemt | Retningsbestemt | Retningsbestemt | Ikke-retningsbestemt |
| Antal obligationer | 2 atomer | 2 atomer | Flere atomer |
| Polaritet | Polar | Polar | Ikke-polær |
Ioniske, kovalente og hydrogenbindinger er alle vigtige typer bindinger, der spiller en rolle i strukturen og funktionen af molekyler og materialer.
 Varme artikler
Varme artikler
-
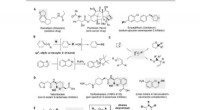 Borindsættelse i alkyletherbindinger via zink/nikkel -tandemkatalyseFunktionalisering af etherbindinger. (A) Småmolekylære lægemidler indeholdende cykliske ethergrupper. Ph, phenyl; Ac, acetyl; Bz, benzoyl; glu, glukose. (B) Overgangsmetal -katalyseret C -O -spaltning
Borindsættelse i alkyletherbindinger via zink/nikkel -tandemkatalyseFunktionalisering af etherbindinger. (A) Småmolekylære lægemidler indeholdende cykliske ethergrupper. Ph, phenyl; Ac, acetyl; Bz, benzoyl; glu, glukose. (B) Overgangsmetal -katalyseret C -O -spaltning -
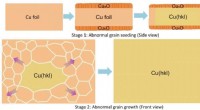 Indstilling af overfladen giver variationer til metalfolierDannelsesmekanisme for store krystallinske Cu -folier med forskellige overflader via annealering af peroxid -Cu -folier. Kredit:IBS Ligesom kloning i biologi muliggør oprettelse af en eller flere
Indstilling af overfladen giver variationer til metalfolierDannelsesmekanisme for store krystallinske Cu -folier med forskellige overflader via annealering af peroxid -Cu -folier. Kredit:IBS Ligesom kloning i biologi muliggør oprettelse af en eller flere -
 Open source-software behandler hurtigt spektrale data, identificerer og kvantificerer lipidarter nø…LIQUID-grænsefladen. Kredit:Pacific Northwest National Laboratory Lipider spiller en nøglerolle i mange stofskiftesygdomme, herunder hypertension, diabetes, og slagtilfælde. Så det er vigtigt at h
Open source-software behandler hurtigt spektrale data, identificerer og kvantificerer lipidarter nø…LIQUID-grænsefladen. Kredit:Pacific Northwest National Laboratory Lipider spiller en nøglerolle i mange stofskiftesygdomme, herunder hypertension, diabetes, og slagtilfælde. Så det er vigtigt at h -
 Sortering af vira med maskinlæringEnkelte viruspartikeldetekteringer ved hjælp af en solid-state nanopore. Kredit:Osaka University Den igangværende globale pandemi har skabt et presserende behov for hurtige tests, der kan diagnost
Sortering af vira med maskinlæringEnkelte viruspartikeldetekteringer ved hjælp af en solid-state nanopore. Kredit:Osaka University Den igangværende globale pandemi har skabt et presserende behov for hurtige tests, der kan diagnost
- Anfald viser omfanget af pangolinfare
- Kvinder, farvearbejdere, der udfylder de fleste job med høj risiko/lav belønning i Washington
- Hvordan samarbejde kan overtrumfe konkurrence i aber
- At forme lys lader 2-D-mikroskoper fange 4-D-data
- Sodtransport bidrager kun lidt til smeltningen af nogle antarktiske gletsjere
- Det sidste 'endelige' søm i WEP's kiste?


