Hvad sker der, når magnesium reagerer med fortyndet svovlsyre?
Mg(s) + H2SO4(aq) → MgSO4(aq) + H2(g)
I denne reaktion:
- Magnesium (Mg) i sin faste form(er) er reaktantmetallet.
- Fortyndet svovlsyre (H2SO4), som er en vandig opløsning, er reaktantsyren.
Reaktionen involverer en enkelt forskydnings- eller substitutionsreaktion. Her er hvad der sker:
1. Magnesiumatomer (Mg) i fast form mister deres to yderste elektroner og bliver hver især til Mg2+ ioner.
2. De tabte elektroner fra magnesiumatomer overføres til hydrogenioner (H+) i svovlsyreopløsningen, hvorved de reduceres til brintgas (H2).
3. De positivt ladede Mg2+-ioner kombineres med de negativt ladede sulfationer (SO42-) fra svovlsyre og danner magnesiumsulfat (MgSO4), som opløses i opløsningen.
Som et resultat dannes magnesiumsulfat (MgSO4), et opløseligt salt, og hydrogengas (H2) frigives som et biprodukt. Denne reaktion er almindeligvis observeret under laboratoriedemonstrationer eller eksperimenter, der involverer reaktivitet af metaller med syrer.
 Varme artikler
Varme artikler
-
 Træbaseret teknologi skaber elektricitet fra varmeKredit:University of Maryland Et team af forskere, der ledes af University of Maryland, har skabt en varme-til-elektricitetsenhed, der kører på ioner, og som en dag kan udnytte kroppens varme for
Træbaseret teknologi skaber elektricitet fra varmeKredit:University of Maryland Et team af forskere, der ledes af University of Maryland, har skabt en varme-til-elektricitetsenhed, der kører på ioner, og som en dag kan udnytte kroppens varme for -
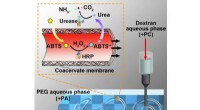 Materialeforskere bygger et syntetisk system med rum som rigtige cellerUMass Amherst materialeforsker Thomas Russell og andre beskriver i et nyt papir, hvordan de drager fordel af forskelle i elektrisk ladning til at skabe en alt vandig, vand-i-vand-konstruktion, der opn
Materialeforskere bygger et syntetisk system med rum som rigtige cellerUMass Amherst materialeforsker Thomas Russell og andre beskriver i et nyt papir, hvordan de drager fordel af forskelle i elektrisk ladning til at skabe en alt vandig, vand-i-vand-konstruktion, der opn -
 Computer redesigner enzymUniversitetet i Groningen videnskabsmænd Dr. Hein Wijma (til venstre) og Prof. Dr. Dick B. Janssen, som brugte en ny beregningsmetode til at redesigne aspartase-enzymet og omdanne det til en katalysat
Computer redesigner enzymUniversitetet i Groningen videnskabsmænd Dr. Hein Wijma (til venstre) og Prof. Dr. Dick B. Janssen, som brugte en ny beregningsmetode til at redesigne aspartase-enzymet og omdanne det til en katalysat -
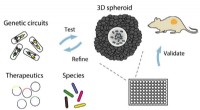 Forskere udvikler en ny platform, der genskaber kræft i et fad for hurtigt at bestemme den bedste b…Bakterier koloniserer multicellulære sfæroider in vitro, hvor de screenes for vækst, kredsløb dynamik, og terapeutisk effekt og derefter valideres i musetumormodeller. Kredit:Tetsuhiro Harimoto/Columb
Forskere udvikler en ny platform, der genskaber kræft i et fad for hurtigt at bestemme den bedste b…Bakterier koloniserer multicellulære sfæroider in vitro, hvor de screenes for vækst, kredsløb dynamik, og terapeutisk effekt og derefter valideres i musetumormodeller. Kredit:Tetsuhiro Harimoto/Columb
- Hvordan er biomasse sammenlignet med fossilt brændstof i mængden af luftforurenende stoffer?
- Forskere rapporterer om afgørende opdagelse af nanomateriale til LED'er
- Nyt gammelt havkrybdyr fundet i Tyskland – det tidligste af sin art
- Enden er nær for Apples iTunes, da teknologigiganten sigter mod separate lyd- og videomarkeder
- Hvis biler har skulderseler, hvorfor så ikke fly?
- Ekspressbaner for ioner:Ved at justere kulstofnanorør i elektroder, forskere øger ydeevnen


