Hvordan kan salt påvirke kogetiden for vand?
1. Kogepunktshøjde: Når du opløser et opløst stof (såsom salt) i et opløsningsmiddel (såsom vand), stiger opløsningens kogepunkt. Det betyder, at vandet med opløst salt vil kræve en højere temperatur for at koge i forhold til rent vand. Kogepunktsstigningen er direkte proportional med mængden af tilstedeværende opløst stof. Så jo mere salt du tilføjer, jo højere bliver kogepunktet, og jo længere tid vil det tage for vandet at koge.
Forhøjelsen af kogepunktet forårsaget af salt er relativt lille sammenlignet med andre opløste stoffer, men den er stadig mærkbar. For eksempel hæver kogepunktet med cirka 0,05 grader Celsius, hvis du tilføjer 1 gram salt til 100 gram vand.
2. Overfladespænding: Salt kan også påvirke vandets overfladespænding. Overfladespænding er den kraft, der får molekylerne ved overfladen af en væske til at blive trukket indad, hvilket skaber en slags "hud" på overfladen. Salt nedsætter vandets overfladespænding. Når vandet koger, dannes der bobler af damp, som stiger til overfladen. Med en lavere overfladespænding har boblerne nemmere ved at slippe ud, hvilket fører til en lidt hurtigere kogeproces.
Salts effekt på vands overfladespænding er relativt lille og har en lille indvirkning på kogetiden.
Så sammenfattende øger salt generelt kogetiden for vand ved at hæve kogepunktet. Størrelsen af denne effekt er dog lille, og andre faktorer som højde og atmosfærisk tryk kan have en mere væsentlig indflydelse på kogetiden.
 Varme artikler
Varme artikler
-
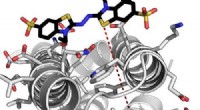 Kunstige enzymfunktioner samt naturlig versionBeregningsmodel for et yderst effektivt de novo -enzym, der interagerer med et af dets substrater. Den røde stiplede linje angiver elektrontunnelafstanden mellem det proteinbundne hæmmolekyle og det b
Kunstige enzymfunktioner samt naturlig versionBeregningsmodel for et yderst effektivt de novo -enzym, der interagerer med et af dets substrater. Den røde stiplede linje angiver elektrontunnelafstanden mellem det proteinbundne hæmmolekyle og det b -
 Forskere tilbyder overblik over kompositmetalskum og potentielle anvendelserForskere ved North Carolina State University har udviklet en række sammensatte metalskum, der er lettere og stærkere end de materialer, de er lavet af. Skummet kan bruges i applikationer fra rustning
Forskere tilbyder overblik over kompositmetalskum og potentielle anvendelserForskere ved North Carolina State University har udviklet en række sammensatte metalskum, der er lettere og stærkere end de materialer, de er lavet af. Skummet kan bruges i applikationer fra rustning -
 Prober kaster nyt lys over Alzheimers årsagRice University-forskere har udviklet et rutheniumbaseret kompleks, der er i stand til at spore dannelsen af opløselige amyloide beta-peptidaggregater, der er impliceret i starten af Alzheimers sy
Prober kaster nyt lys over Alzheimers årsagRice University-forskere har udviklet et rutheniumbaseret kompleks, der er i stand til at spore dannelsen af opløselige amyloide beta-peptidaggregater, der er impliceret i starten af Alzheimers sy -
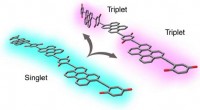 To-til-en energi fra fotoner, nu bedre end nogensindeVed at vride, når man er ophidset, nogle lange kæder af organiske molekyler kan isolere triplet excitoner i modsatte ender af molekylet. Kredit:National Renewable Energy Laboratory Ved vridning og
To-til-en energi fra fotoner, nu bedre end nogensindeVed at vride, når man er ophidset, nogle lange kæder af organiske molekyler kan isolere triplet excitoner i modsatte ender af molekylet. Kredit:National Renewable Energy Laboratory Ved vridning og
- Eksempler på kolligativ ejendom
- Gamle nordamerikanske krybdyr levede på en øgruppe i det sydlige Wales
- Mikrochipimplantater truer arbejdstagernes rettigheder
- Test viser, at nogle bakterier kan overleve under Mars-forhold
- Hvad er en meget nyttig form for energi til drift af apparater?
- Er Chewbacca og Bigfoot relateret?


