Er hastigheden af en kemisk reaktion afhængig af temperaturen?
```
k =Ae^(-Ea/RT)
```
hvor:
* k er hastighedskonstanten
* A er den præ-eksponentielle faktor
* Ea er aktiveringsenergien
* R er den ideelle gaskonstant
* T er den absolutte temperatur
Aktiveringsenergien (Ea) repræsenterer den minimale energi, der kræves for, at reaktanterne kan nå overgangstilstanden og danne produkter. Når temperaturen stiger, stiger den gennemsnitlige kinetiske energi af reaktantmolekylerne også, hvilket fører til en højere sandsynlighed for kollisioner med nok energi til at overvinde aktiveringsenergibarrieren. Derfor stiger hastighedskonstanten (k) eksponentielt med temperaturen.
Dette forhold mellem temperatur og reaktionshastighed observeres eksperimentelt og har betydelige implikationer på forskellige områder, såsom kemiteknik, industrielle processer, biokemi og miljøkemi.
 Varme artikler
Varme artikler
-
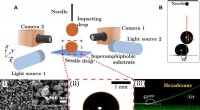 Løft af en siddende dråbe fra en superamfifob overflade ved hjælp af en stødende dråbeEksperimentel tilgang og det fastsiddende fald. (A) Skitse af den eksperimentelle opsætning for binær dråbepåvirkning på superamfifobe overflader. Nålen er fikseret for at indstille stødhøjden i Z-ret
Løft af en siddende dråbe fra en superamfifob overflade ved hjælp af en stødende dråbeEksperimentel tilgang og det fastsiddende fald. (A) Skitse af den eksperimentelle opsætning for binær dråbepåvirkning på superamfifobe overflader. Nålen er fikseret for at indstille stødhøjden i Z-ret -
 Grundstoffer kan være faste og flydende på samme tid, undersøgelse afslørerKredit:CC0 Public Domain Forskere har opdaget en ny tilstand af fysisk stof, hvor atomer kan eksistere som både faste og flydende samtidigt. Indtil nu, atomerne i fysisk materiale blev forstået a
Grundstoffer kan være faste og flydende på samme tid, undersøgelse afslørerKredit:CC0 Public Domain Forskere har opdaget en ny tilstand af fysisk stof, hvor atomer kan eksistere som både faste og flydende samtidigt. Indtil nu, atomerne i fysisk materiale blev forstået a -
 Salt smelter ikke is - her er hvordan det faktisk gør vintergader sikreSprøjtning af salt på veje er en sikkerhedsforanstaltning. Kredit:stoatphoto/Shutterstock.com Brrr ... det er koldt derude! Børn strømmer til fjernsynet i håb om at høre, at der kommer en snedag;
Salt smelter ikke is - her er hvordan det faktisk gør vintergader sikreSprøjtning af salt på veje er en sikkerhedsforanstaltning. Kredit:stoatphoto/Shutterstock.com Brrr ... det er koldt derude! Børn strømmer til fjernsynet i håb om at høre, at der kommer en snedag; -
 Ny produktion af fullerenkrystal 50 gange hurtigere end forgængeren(a) Foto af produceret FFMP på kvartsplade og (b)-(d) scanningselektronmikroskopbilleder af prøver. Kredit:Yokohama National University Forskere fra Yokohama National University og University of E
Ny produktion af fullerenkrystal 50 gange hurtigere end forgængeren(a) Foto af produceret FFMP på kvartsplade og (b)-(d) scanningselektronmikroskopbilleder af prøver. Kredit:Yokohama National University Forskere fra Yokohama National University og University of E
- Forurenet luft forårsager tidlige dødsfald på fossilt brændstof på Balkan
- Er Na2HPO4 en base eller syre?
- Droner hjælper med at kalibrere radioteleskop på Brookhaven Lab
- Hvad er den kemiske forbindelse for argon?
- Nyt stål for at fordoble levetiden for oliefeltsrørledninger
- Genopdagelse kan standse verdensomspændende hvedeepidemi


