Hvilken type binding eller interaktion ville være svær at afbryde, når forbindelser sættes i vand?
Ionbindinger dannes af den elektrostatiske tiltrækning mellem positivt og negativt ladede ioner. Når en ionforbindelse er opløst i vand, opløser vandmolekylerne ionerne, omgiver dem og adskiller dem fra hinanden. Dette reducerer den elektrostatiske tiltrækning mellem ionerne, men det forstyrrer ikke fuldstændigt ionbindingen.
For eksempel, når natriumchlorid (NaCl) opløses i vand, omgiver vandmolekylerne natrium- og chloridionerne og danner en hydreringskugle omkring hver ion. Denne hydreringssfære reducerer den elektrostatiske tiltrækning mellem natrium- og chloridionerne, men den forstyrrer ikke fuldstændigt ionbindingen. Natrium- og chloridionerne forbliver bundet sammen som et ionpar.
I modsætning hertil er kovalente bindinger og hydrogenbindinger meget svagere end ionbindinger. Kovalente bindinger dannes ved deling af elektroner mellem atomer, og hydrogenbindinger dannes af den elektrostatiske tiltrækning mellem et hydrogenatom og et elektronegativt atom. Disse bindinger afbrydes let af vandmolekyler, som kan opløse atomerne og bryde bindingerne.
Derfor er ionbindinger den sværeste type binding eller interaktion at forstyrre, når forbindelser sættes i vand.
Sidste artikelHvad er ionisk ladning af bromat?
Næste artikelHvordan finder man ud af valensskal og elektroner?
 Varme artikler
Varme artikler
-
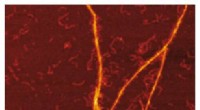 Templating S100A9 amyloider på Aβ fibrillar overflader afsløretAFM -billede af amyloid -skabelonen af S100A9 -fibriller på overfladen af Aβ -fibriller. Kredit:Jonathan Pansieri Et forskerhold ledet af Ludmilla Morozova Roche ved Umeå Universitet, Sverige,
Templating S100A9 amyloider på Aβ fibrillar overflader afsløretAFM -billede af amyloid -skabelonen af S100A9 -fibriller på overfladen af Aβ -fibriller. Kredit:Jonathan Pansieri Et forskerhold ledet af Ludmilla Morozova Roche ved Umeå Universitet, Sverige, -
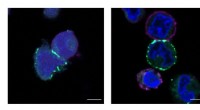 Team belyser mikro-miljøet, at skabe en ny vej til kræftmedicinPrincetons MacMillan Group udviklede en ny teknologi kaldet μMap, der identificerer proteiners nærmeste naboer på celleoverflader. Disse billeder viser celler, der mærkes, eller markeret med grønt, af
Team belyser mikro-miljøet, at skabe en ny vej til kræftmedicinPrincetons MacMillan Group udviklede en ny teknologi kaldet μMap, der identificerer proteiners nærmeste naboer på celleoverflader. Disse billeder viser celler, der mærkes, eller markeret med grønt, af -
 Spinat:Kemiforsøg viser potentiale til at drive brændselscellerKredit:Pixabay/CC0 Public Domain Spis din spinat, er et almindeligt afhold fra mange menneskers barndom. Spinat, den hjertelige, grønne grøntsager fyldt med næringsstoffer, giver ikke kun energi
Spinat:Kemiforsøg viser potentiale til at drive brændselscellerKredit:Pixabay/CC0 Public Domain Spis din spinat, er et almindeligt afhold fra mange menneskers barndom. Spinat, den hjertelige, grønne grøntsager fyldt med næringsstoffer, giver ikke kun energi -
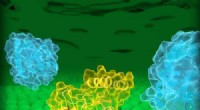 Forskere rapporterer den første 3D-struktur af DHHC-enzymerHuman DHHC20 (gul) er indlejret i Golgi-membranen (grøn), et rum placeret inde i celler. DHHC20 knytter en fedtsyrekæde (hvid) til et målprotein (blå, forgrund), som forankrer proteinet til Golgi-memb
Forskere rapporterer den første 3D-struktur af DHHC-enzymerHuman DHHC20 (gul) er indlejret i Golgi-membranen (grøn), et rum placeret inde i celler. DHHC20 knytter en fedtsyrekæde (hvid) til et målprotein (blå, forgrund), som forankrer proteinet til Golgi-memb
- Et energieffektivt middel til restaurering af vandskader
- Hvorfor det er vigtigt at finde ud af, hvordan kalium ødelægges i stjerner, for at forstå univers…
- Forskere ser frigivelse af kræftlægemidler fra DNA-nanostrukturer i realtid
- Ved at bruge mikrobølger til at bryde sten sparer du energi
- Hvad er den specifikke tyngdekraft for vand?
- Brug af pektin til at fremme neuronlignende elektroniske systemer


