Hvad gør nogle grundstoffer til ioner?
1. Elektronforstærkning (aniondannelse):
- Ikke-metalliske grundstoffer har en tendens til at få elektroner for at færdiggøre deres yderste elektronskal og opnå en stabil konfiguration svarende til den nærmeste ædelgas.
- Disse tilføjede elektroner giver atomet en negativ ladning, og det bliver til en anion .
2. Elektrontab (kationdannelse):
- Metalliske grundstoffer mister generelt elektroner fra deres yderste skal for at opnå en stabil elektronkonfiguration, der ligner den nærmeste ædelgas.
- Disse tabte elektroner forlader atomet med en positiv ladning og omdanner det til en kation .
Ioniseringsprocessen afhænger af forskellige faktorer, herunder:
a. Elektronegativitet:
- Elektronegativitet måler et atoms tiltrækning af elektroner. Ikke-metalliske elementer har høj elektronegativitet, hvilket får dem til at få elektroner, mens metaller har lav elektronegativitet, hvilket favoriserer elektrontab.
b. Valenselektroner:
- Grundstoffer med en, to eller tre valenselektroner har en tendens til let at miste dem og danner kationer, mens dem med fem, seks eller syv valenselektroner foretrækker at få elektroner og blive til anioner.
c. Ioniseringsenergi:
- Ioniseringsenergi er den energi, der kræves for at fjerne en elektron fra et atom. Jo højere ioniseringsenergi, jo stærkere tiltrækning mellem atomet og dets elektroner, hvilket gør det mindre sandsynligt, at det danner en ion.
Sammenfattende opnår elementer ioniske former ved at udveksle elektroner for at opnå stabile elektronkonfigurationer, der ligner ædelgasser, og dermed erhverve enten negative (anioner) eller positive (kationer) ladninger.
Sidste artikelHvilke sammensatte ord har kridt?
Næste artikelHvad indikerer -ate eller -ite i slutningen af en forbindelse?
 Varme artikler
Varme artikler
-
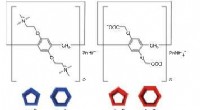 Selvsortering gennem molekylære geometrierStrukturer af søjle [n] arenaer, n =5 og 6. Venstre, blå:kationiske (positivt ladede) varianter; ret, rød:anioniske (negativt ladede) varianter. Kredit:Kanazawa University Forskere ved Kanazawa Un
Selvsortering gennem molekylære geometrierStrukturer af søjle [n] arenaer, n =5 og 6. Venstre, blå:kationiske (positivt ladede) varianter; ret, rød:anioniske (negativt ladede) varianter. Kredit:Kanazawa University Forskere ved Kanazawa Un -
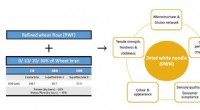 Nudler beriget med kostfibre af avanceret teknologi forbliver velsmagendeFigur 1:Grafisk repræsentation af de (venstre) eksperimentelle parametre og de (højre) attributter studeret som en del af denne forskning. Kredit:National University of Singapore NUS-fødevareforsk
Nudler beriget med kostfibre af avanceret teknologi forbliver velsmagendeFigur 1:Grafisk repræsentation af de (venstre) eksperimentelle parametre og de (højre) attributter studeret som en del af denne forskning. Kredit:National University of Singapore NUS-fødevareforsk -
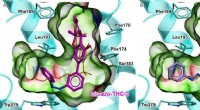 Berusende lysfølsommeTo lysfølsomme THC -derivater, og hvordan de er indlejret i cannabinoidreceptoren 1. Kredit:fra Westphal MV et al. J. Am. Chemical Soc., 2017, 139 (50), s. 18206-18212. ETH -kemikere har syntetise
Berusende lysfølsommeTo lysfølsomme THC -derivater, og hvordan de er indlejret i cannabinoidreceptoren 1. Kredit:fra Westphal MV et al. J. Am. Chemical Soc., 2017, 139 (50), s. 18206-18212. ETH -kemikere har syntetise -
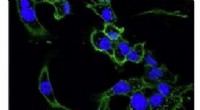 Polymer afledt af materiale i rejeskaller kunne levere anti-cancermedicin til tumorstederDisse billeder viser brystkræftceller fra mus taget under et mikroskop. På begge billeder grøn angiver cellemembranen, og blå angiver kernen. Celler i det nederste billede er blevet behandlet med Taxo
Polymer afledt af materiale i rejeskaller kunne levere anti-cancermedicin til tumorstederDisse billeder viser brystkræftceller fra mus taget under et mikroskop. På begge billeder grøn angiver cellemembranen, og blå angiver kernen. Celler i det nederste billede er blevet behandlet med Taxo
- Gør computeranimation mere smidig, akrobatisk - og realistisk
- Hvilken del af planten skaber frø
- Forskere udvikler en ny tilgang til at forudsige, hvordan væsker fryser
- Nye målinger viser, at månen har farlige strålingsniveauer
- Et atom med et ufuldstændigt fyldt yderste energiniveau er sandsynligvis?
- Hvad ville du få, hvis du blandede kobber med saltsyre?


