For reaktionen er Cl2 plus 2KBr lig med Br2, beregn procentvis udbytte, hvis 200 g reagerer med overskydende KBr for at producere 410 Br2?
1 mol Cl2 reagerer med 2 mol KBr for at producere 1 mol Br2.
Den molære masse af Cl2 er 70,9 g/mol, og den molære masse af Br2 er 159,8 g/mol.
Derfor er 200 g Cl2 lig med 200 g / 70,9 g/mol =2,82 mol Cl2.
Ifølge støkiometrien vil 2,82 mol Cl2 reagere med 2 x 2,82 =5,64 mol KBr for at producere 2,82 mol Br2.
Det teoretiske udbytte af Br2 er derfor 2,82 mol x 159,8 g/mol =452,3 g.
Nu kan vi beregne det procentvise udbytte:
Udbytte i procent =(Faktisk udbytte / Teoretisk udbytte) x 100 %
Det faktiske udbytte er angivet til 410 g.
Udbytte i procent =(410 g / 452,3 g) x 100 % =90,6 %
Derfor er det procentvise udbytte af Br2 i denne reaktion 90,6%.
Sidste artikelHvor mange brintmolekyler indeholder vand?
Næste artikelEr de fleste kemiske reaktioner i ligevægt i levende celler?
 Varme artikler
Varme artikler
-
 Overraskende opdagelse af celledød giver fingerpeg om fødselsdefekterForskere har gjort en overraskende opdagelse, der kunne omskrive vores forståelse af den rolle, programmeret celledød spiller i embryonisk udvikling og medfødte fosterskader. ledet af Dr. Francine Ke
Overraskende opdagelse af celledød giver fingerpeg om fødselsdefekterForskere har gjort en overraskende opdagelse, der kunne omskrive vores forståelse af den rolle, programmeret celledød spiller i embryonisk udvikling og medfødte fosterskader. ledet af Dr. Francine Ke -
 Forskere bruger nitrogenoxidopfangere til at målrette mod triple-negativ brystkræftBiomakromolekyler DOI:10.1021/acs.biomac.2c00545 Forskere udforsker en potentiel ny terapeutisk tilgang til tredobbelt negativ brystkræftbehandling. Amir Abdo Alsharabasy, en CÚRAM ph.d.-kandidat,
Forskere bruger nitrogenoxidopfangere til at målrette mod triple-negativ brystkræftBiomakromolekyler DOI:10.1021/acs.biomac.2c00545 Forskere udforsker en potentiel ny terapeutisk tilgang til tredobbelt negativ brystkræftbehandling. Amir Abdo Alsharabasy, en CÚRAM ph.d.-kandidat, -
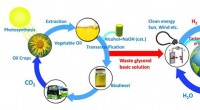 Fra et biprodukt fra biodieselindustrien til bæredygtig produktion af et værdifuldt kemikalieEt af de vigtigste affaldsbiprodukter fra biodieselindustrien, glycerol, kan bruges som råmateriale til dannelse af værdifuld dihydroxyaceton og hydrogen, sidstnævnte kan bruges som 100% rent brændsto
Fra et biprodukt fra biodieselindustrien til bæredygtig produktion af et værdifuldt kemikalieEt af de vigtigste affaldsbiprodukter fra biodieselindustrien, glycerol, kan bruges som råmateriale til dannelse af værdifuld dihydroxyaceton og hydrogen, sidstnævnte kan bruges som 100% rent brændsto -
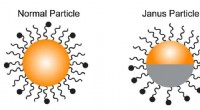 Kemikere skaber en kemisk sonde for bedre at forstå immunresponsOpkaldt efter den to-ansigtede romerske gud, en Janus partikel, ret, er belagt med to separate molekyletyper på tværs af overfladen. Kredit:Lucy Sanchez En trio af kemikere ved Indiana University
Kemikere skaber en kemisk sonde for bedre at forstå immunresponsOpkaldt efter den to-ansigtede romerske gud, en Janus partikel, ret, er belagt med to separate molekyletyper på tværs af overfladen. Kredit:Lucy Sanchez En trio af kemikere ved Indiana University
- Historiske vandstande ved Iraks reservoirer og dæmninger:Embedsmænd
- Musikeksperimenter til Kids
- Hvad gør stormjagere egentlig? To tornado-forskere forklarer jagten og værktøjerne til at studere…
- Hvordan vejnettet bestemmer trafikkapaciteten
- Sådan fungerer selvmordsbombere
- Værdier og køn former unge voksnes iværksætteri og lederskab


