27,0 ml 0,45 m naoh neutraliseres af 20 en hcl opløsning molariteten er?
NaOH + HCl → NaCl + H2O
For at bestemme molariteten af HCl-opløsningen kan vi bruge formlen:
Mol HCl =Molaritet af NaOH × Volumen af NaOH (i liter)
Først skal vi konvertere volumenet af NaOH fra milliliter (mL) til liter (L):
Volumen af NaOH =27,0 ml =0,027 L
Nu kan vi beregne mol HCl:
Mol HCl =0,45 M × 0,027 L =0,01215 mol
Dernæst skal vi finde volumen af HCl-opløsning, der reagerede med de 0,01215 mol HCl. Lad os antage, at volumenet af HCl-opløsning er V liter.
Molaritet af HCl =Mol HCl / Volumen af HCl (i liter)
0,20 M =0,01215 mol/V
Ved at løse for V får vi:
V =0,01215 mol / 0,20 M =0,06075 L
Derfor er molariteten af HCl-opløsningen 0,20 M, og volumenet af HCl-opløsning, der kræves til neutralisering, er 0,06075 L eller 60,75 ml.
 Varme artikler
Varme artikler
-
 Forskere biosyntetiserer anti-kræftforbindelse fundet i giftige australske træerStinging Tree i det nordlige Queensland. Kredit:Rainer Wunderlich, CC BY-SA 3.0 Det australske stikkende træ (Dendrocnide moroides) er en plante, som mange mennesker undgår for enhver pris. Træet,
Forskere biosyntetiserer anti-kræftforbindelse fundet i giftige australske træerStinging Tree i det nordlige Queensland. Kredit:Rainer Wunderlich, CC BY-SA 3.0 Det australske stikkende træ (Dendrocnide moroides) er en plante, som mange mennesker undgår for enhver pris. Træet, -
 Skorpioner laver en fluorescerende forbindelse, der kan hjælpe med at beskytte dem mod parasitterFluorescerende forbindelser i eksoskelet af skorpioner får skabningerne til at lyse, når de ses under et sort (ultraviolet) lys. Kredit:Tilpasset fra Journal of Natural Products 2020, DOI:10.1021/ac
Skorpioner laver en fluorescerende forbindelse, der kan hjælpe med at beskytte dem mod parasitterFluorescerende forbindelser i eksoskelet af skorpioner får skabningerne til at lyse, når de ses under et sort (ultraviolet) lys. Kredit:Tilpasset fra Journal of Natural Products 2020, DOI:10.1021/ac -
 Bevægelse væk fra plastik:Etuiet med solid body washKredit:CC0 Public Domain For forbrugere, der forsøger at undgå plastik og blive grønne, solid body wash, der sælges uden emballage, ser ud til at være et godt alternativ til indpakkede og flaskes
Bevægelse væk fra plastik:Etuiet med solid body washKredit:CC0 Public Domain For forbrugere, der forsøger at undgå plastik og blive grønne, solid body wash, der sælges uden emballage, ser ud til at være et godt alternativ til indpakkede og flaskes -
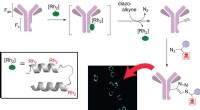 Metal forenkler syntesen af antistoflægemidlerRice University-kemikere har designet et plug-in metalloprotein for at forenkle opgaven med at lave målrettede antistofterapier. Forskerne brugte et tredobbeltmetaliseret peptid (indsat) til at give e
Metal forenkler syntesen af antistoflægemidlerRice University-kemikere har designet et plug-in metalloprotein for at forenkle opgaven med at lave målrettede antistofterapier. Forskerne brugte et tredobbeltmetaliseret peptid (indsat) til at give e
- Plasmabehandlinger dræber hurtigt coronavirus på overflader
- Hvorfor er vi nødt til at spare på vand?
- Hvilke faktorer påvirker sandsynligheden for fracking-relateret seismicitet i Oklahoma?
- Trump underskriver en bekendtgørelse, der tillader minedrift af månen og asteroider
- Sådan bruges betydelige tal i multiplikation og division
- Hvilket vaskemiddel fungerer bedst til et videnskabsmæssigt projekt?


