Hvilke derivater af ethan har det højeste kogepunkt?
Kogepunktet for en forbindelse bestemmes af styrken af de intermolekylære kræfter mellem dens molekyler. Jo stærkere intermolekylære kræfter, jo højere kogepunkt.
De intermolekylære kræfter mellem molekyler kan være dipol-dipol-interaktioner, hydrogenbinding eller van der Waals-kræfter.
Dipol-dipol-interaktioner forekommer mellem molekyler med permanente dipolmomenter. Hydrogenbinding er en speciel type dipol-dipol-interaktion, der forekommer mellem molekyler med et brintatom bundet til et meget elektronegativt atom (såsom nitrogen, oxygen eller fluor). Van der Waals-kræfter er svage tiltrækningskræfter, der opstår mellem alle molekyler.
Kogepunktet for en forbindelse stiger, når antallet af intermolekylære kræfter mellem dets molekyler stiger.
2,2-dimethylpropan har det højeste kogepunkt af alle derivater af ethan, fordi det har de mest intermolekylære kræfter. 2,2-dimethylpropan er et ikke-polært molekyle, så det har ingen dipol-dipol-interaktioner eller hydrogenbinding. Det har dog stærke van der Waals-kræfter, fordi det er et stort molekyle med meget overfladeareal.
De andre derivater af ethan har færre intermolekylære kræfter end 2,2-dimethylpropan. For eksempel er ethan et upolært molekyle, så det har kun van der Waals-kræfter. Butan er også et ikke-polært molekyle, men det har et højere kogepunkt end ethan, fordi det er et større molekyle med mere overfladeareal. Propen er et polært molekyle, så det har dipol-dipol-interaktioner ud over van der Waals-kræfter. Propen har dog et lavere kogepunkt end 2,2-dimethylpropan, fordi det er et mindre molekyle med mindre overfladeareal.
Derfor har 2,2-dimethylpropan det højeste kogepunkt af alle derivater af ethan, fordi det har de mest intermolekylære kræfter.
 Varme artikler
Varme artikler
-
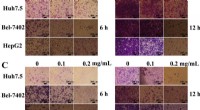 Marine bakterielt exopolysaccharid EPS11 hæmmer migration og invasion af levercancercellerFigur 1EPS11 hæmmer migration, invasion og kolonidannelse af levercancerceller (Huh7.5, Bel-7402, og HepG2 -cellelinjer). (A) Observation af fi liform-strukturer i Bel-7402 og HepG2-celler efter behand
Marine bakterielt exopolysaccharid EPS11 hæmmer migration og invasion af levercancercellerFigur 1EPS11 hæmmer migration, invasion og kolonidannelse af levercancerceller (Huh7.5, Bel-7402, og HepG2 -cellelinjer). (A) Observation af fi liform-strukturer i Bel-7402 og HepG2-celler efter behand -
 Medicin du kan bæreKredit:Swiss Federal Laboratories for Materials Science and Technology Narkotikafrigørende tekstiler kunne, for eksempel, bruges til at behandle hudsår. Empa-forskere er i øjeblikket ved at udvikl
Medicin du kan bæreKredit:Swiss Federal Laboratories for Materials Science and Technology Narkotikafrigørende tekstiler kunne, for eksempel, bruges til at behandle hudsår. Empa-forskere er i øjeblikket ved at udvikl -
 Fremstilling af stof af træKredit:Janko Ferlic Som et materiale har træ mange anvendelsesmuligheder, men vidste du, at det kan bruges til at lave fibre til tøj og andre tekstiler? Måske overraskende, det er råmaterialet i n
Fremstilling af stof af træKredit:Janko Ferlic Som et materiale har træ mange anvendelsesmuligheder, men vidste du, at det kan bruges til at lave fibre til tøj og andre tekstiler? Måske overraskende, det er råmaterialet i n -
 Stigning af mandlige individer i stingless bier kolonier fører til dronninger dødUndersøgelse tyder på fremkomsten af hanbier med både faderligt og moderligt genetisk materiale ubalancer arbejdsstyrke i kolonier af Scaptotrigona depilis (fysogastrisk dronning inspicerer yngelc
Stigning af mandlige individer i stingless bier kolonier fører til dronninger dødUndersøgelse tyder på fremkomsten af hanbier med både faderligt og moderligt genetisk materiale ubalancer arbejdsstyrke i kolonier af Scaptotrigona depilis (fysogastrisk dronning inspicerer yngelc
- Tørke kan ramme aldrende kraftværker hårdt
- Billede af adgang til energi for alle i Afrika syd for Sahara
- En effektiv tilgang til fremstilling af supramolekylære polymerer ved høj koncentration
- Mælkevejens skive er skæv. Er det fordi dens mørke stof halo vippede?
- Overvej livet i havet, når du implementerer offshore vedvarende energi
- Skyerne af spaghetti, der holder DNA-data sikre


