Hvilke dele af et atom bestemmer dets kemiske egenskaber?
1. Atomnummer: Et grundstofs atomnummer repræsenterer antallet af protoner i kernen. Hvert grundstof har et unikt atomnummer, som definerer dets identitet i det periodiske system.
2. Elektronkonfiguration: Elektronkonfigurationen beskriver arrangementet af elektroner i forskellige energiniveauer og orbitaler omkring kernen. Valenselektroner er placeret i det yderste energiniveau (valensskal). Grundstoffer med lignende valenselektronkonfigurationer har tendens til at udvise lignende kemiske egenskaber.
3. Antal valenselektroner: Antallet af valenselektroner i et atom bestemmer dets valens eller kombinationsevne. Grundstoffer med det samme antal valenselektroner tilhører den samme gruppe (lodret søjle) i det periodiske system og deler lignende kemiske egenskaber. For eksempel har alle grundstoffer i gruppe 1 (alkalimetaller) en valenselektron og er meget reaktive.
4. Elektronaffinitet: Elektronaffinitet refererer til atomets evne til at tiltrække og holde på yderligere elektroner. Denne egenskab er vigtig ved dannelse af kemiske bindinger og bestemmelse af et atoms reaktivitet.
5. Ioniseringsenergi: Ioniseringsenergi er den energi, der kræves for at fjerne en elektron fra et atom. Det giver en indikation af et atoms tendens til at miste eller få elektroner. Lav ioniseringsenergi betyder generelt, at atomet let kan miste elektroner, mens høj ioniseringsenergi tyder på en stærk tiltrækning af elektroner.
6. Elektronegativitet: Elektronegativitet måler et atoms evne til at tiltrække elektroner, når det er bundet til et andet atom. Atomer med høj elektronegativitet har en tendens til at trække elektroner mod sig selv og danner polære bindinger.
7. Atomstørrelse: Størrelsen af et atom, som bestemmes af antallet af energiniveauer og den afskærmende effekt af indre elektroner, påvirker dets kemiske adfærd. Mindre atomer har højere elektronegativitet og har tendens til at danne stærkere bindinger sammenlignet med større atomer.
Forståelse af antallet af valenselektroner, elektronkonfiguration og egenskaber såsom elektronaffinitet, ioniseringsenergi og elektronegativitet gør det muligt for kemikere at forudsige grundstoffernes kemiske adfærd, og hvordan de vil interagere med andre atomer for at danne forbindelser.
 Varme artikler
Varme artikler
-
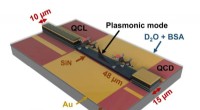 Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel
Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel -
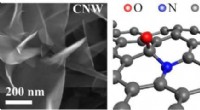 Alternativ til nitrogen:Oxygenplasma kan forbedre elektrodematerialers egenskaberSEM -billede af Carbon NanoWalls (CNW), en mulig position af ilt og nitrogen heteroatomer, cykliske voltammetri -kurver i sur elektrolyt. Kredit:Skolkovo Institute of Science and Technology En gru
Alternativ til nitrogen:Oxygenplasma kan forbedre elektrodematerialers egenskaberSEM -billede af Carbon NanoWalls (CNW), en mulig position af ilt og nitrogen heteroatomer, cykliske voltammetri -kurver i sur elektrolyt. Kredit:Skolkovo Institute of Science and Technology En gru -
 Nye molekyler for at reducere omkostningerne, miljøpåvirkning af minedrift af ædelmetallerKredit:University of Notre Dame Forskere ved University of Notre Dame har opfundet en ny klasse af molekyler, der kan bruges til at forenkle processen, der bruges til at fange ædelmetaller, herund
Nye molekyler for at reducere omkostningerne, miljøpåvirkning af minedrift af ædelmetallerKredit:University of Notre Dame Forskere ved University of Notre Dame har opfundet en ny klasse af molekyler, der kan bruges til at forenkle processen, der bruges til at fange ædelmetaller, herund -
 Tager ansvaret:Forskere går sammen om at lave bedre batterierAdjunkt Jose Mendoza-Cortes og postdoc-forsker A. Nijamudheen gik sammen med forskere fra Cornell for at designe et mere effektivt batteri. Kredit:Florida State University Et forskningshold fra Fl
Tager ansvaret:Forskere går sammen om at lave bedre batterierAdjunkt Jose Mendoza-Cortes og postdoc-forsker A. Nijamudheen gik sammen med forskere fra Cornell for at designe et mere effektivt batteri. Kredit:Florida State University Et forskningshold fra Fl
- Undersøgelse finder gamle jordens fingeraftryk i unge vulkanske klipper
- Hvad tror du, der smelter is hurtigere salt sukker peber?
- Hydrofob nanostruktureret træmembran til termisk effektiv destillation
- Curiosity smager første prøve i lerbærende enhed
- Telematik -teknologi styrer mod smartere EU -veje
- Ny membran fremskridder billigt, energilagring i netskala


