Hvad er første ordens cyklus reversibel reaktion?
Et eksempel på en første ordens cyklus reversibel reaktion er reaktionen af brint og oxygen til dannelse af vand. Reaktionen kan repræsenteres ved følgende ligning:
$$2H_2 + O_2 \rightleftharpoons 2H_2O$$
I denne reaktion er hydrogen- og oxygenmolekylerne reaktanterne, og vandmolekylerne er produkterne. Reaktionen er første orden med hensyn til hydrogenkoncentrationen og anden orden med hensyn til oxygenkoncentrationen. Reaktionen er også reversibel, hvilket betyder, at vandmolekylerne kan omdannes tilbage til brint- og iltmolekyler under de samme betingelser.
Hastigheden af en første ordens cyklus reversibel reaktion kan udtrykkes ved følgende ligning:
$$rate =k[A]^n[B]^m$$
hvor:
* k er hastighedskonstanten
* [A] er koncentrationen af reaktant A
* [B] er koncentrationen af reaktant B
* n er rækkefølgen af reaktionen i forhold til reaktant A
* m er rækkefølgen af reaktionen i forhold til reaktant B
For en førsteordens cyklusreversibel reaktion er hastighedskonstanten lig med produktet af fremadgående hastighedskonstanten og den omvendte hastighedskonstanten. Fremadgående hastighedskonstanten er hastighedskonstanten for den fremadrettede reaktion, og den omvendte hastighedskonstanten er hastighedskonstanten for den omvendte reaktion.
Ligevægtskonstanten for en førsteordens cyklusreversibel reaktion kan udtrykkes ved følgende ligning:
$$K_c =\frac{[C]^c}{[A]^a[B]^b}$$
hvor:
* Kc er ligevægtskonstanten
* [C] er koncentrationen af produktet C
* [A] er koncentrationen af reaktant A
* [B] er koncentrationen af reaktant B
* a er rækkefølgen af reaktionen i forhold til reaktant A
* b er rækkefølgen af reaktionen i forhold til reaktant B
* c er rækkefølgen af reaktionen i forhold til produkt C
Ligevægtskonstanten for en reversibel reaktion i første ordens cyklus er lig med forholdet mellem den fremadrettede hastighedskonstant og den omvendte hastighedskonstant.
 Varme artikler
Varme artikler
-
 Ny katalysatormetode lover bedre brug af syngas, kulKredit:CC0 Public Domain Verdens første projekt til industrielt at syntetisere 25 kt/a af højere alkoholer fra syngas bestod en kontinuerlig 72-timers katalysatorpræstationstest den 3. november, 2
Ny katalysatormetode lover bedre brug af syngas, kulKredit:CC0 Public Domain Verdens første projekt til industrielt at syntetisere 25 kt/a af højere alkoholer fra syngas bestod en kontinuerlig 72-timers katalysatorpræstationstest den 3. november, 2 -
 Nøglen til forbedret grøn teknologieffektivitet fundet i simpel syrebehandlingForynget overflade forbedrer iltelektrode-elektrolytgrænsefladestyrken. Kredit:Nature (2022). DOI:10.1038/s41586-022-04457-y Udviklingen af nye, mere effektive elektrokemiske celler kunne være en
Nøglen til forbedret grøn teknologieffektivitet fundet i simpel syrebehandlingForynget overflade forbedrer iltelektrode-elektrolytgrænsefladestyrken. Kredit:Nature (2022). DOI:10.1038/s41586-022-04457-y Udviklingen af nye, mere effektive elektrokemiske celler kunne være en -
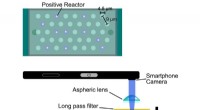 Smartphone virusscanner:Ny bærbar enhed lader smartphones tælle biologiske viraDe virusholdige hulrum er 4,5 mikrometer på tværs og 9 mikrometer fra hinanden. Kredit:Minagawa et al. Den nuværende førende metode til at vurdere tilstedeværelsen af vira og andre biologiske ma
Smartphone virusscanner:Ny bærbar enhed lader smartphones tælle biologiske viraDe virusholdige hulrum er 4,5 mikrometer på tværs og 9 mikrometer fra hinanden. Kredit:Minagawa et al. Den nuværende førende metode til at vurdere tilstedeværelsen af vira og andre biologiske ma -
 Forskere udvikler grønne alternativer til fossile råvarerStefan Spirk vil erstatte miljøskadelige komponenter med biobaserede materialer, primært stoffer fra papir- og papirmasseindustrien. © Lunghammer – TU Graz Som en vedvarende ressource, træ rummer
Forskere udvikler grønne alternativer til fossile råvarerStefan Spirk vil erstatte miljøskadelige komponenter med biobaserede materialer, primært stoffer fra papir- og papirmasseindustrien. © Lunghammer – TU Graz Som en vedvarende ressource, træ rummer
- Hvorfor det er afgørende at studere astronauters mikrobiomer for at sikre en succes med en dyb rumm…
- Delhis fattige bærer hovedparten af dødbringende smog
- Great Plains of North America Dyr & Planter
- Team skaber mikrorobotter drevet af luftbobler og ultralyd
- Firben i din bagage? Vi bruger kunstig intelligens til at opdage handel med vilde dyr
- Ny teknik kaster lys over kropssprog i jobsamtaler, salgsopkald, team projekter


