Hvorfor buffer modstå ændringer i PH, når en lille mængde syre eller base tilsættes?
Her er en forenklet forklaring:
1. Svag syrebuffer :
Overvej en bufferopløsning indeholdende en svag syre (HA) og dens konjugerede base (A-). Når en lille mængde syre tilsættes, sker følgende reaktion:
HA + H+ → A- + H3O+ (Hydroniumion)
I denne reaktion donerer den svage syre (HA) protoner til opløsningen og kombinerer med de tilsatte H+ ioner for at danne mere af dens konjugerede base (A-). Dette forhindrer et signifikant fald i pH, fordi de yderligere H+ ioner forbruges af den svage syre.
2. Svag basebuffer :
På samme måde kan en bufferopløsning indeholdende en svag base (B) og dens konjugerede syre (HB+) neutralisere små mængder tilsat base:
B + OH- → HB+ + H2O (vand)
I dette tilfælde accepterer konjugatsyren (HB+) de tilsatte hydroxidioner (OH-), omdanner dem til vandmolekyler og øger koncentrationen af dens konjugerede base (B). Dette forhindrer en væsentlig stigning i pH, fordi de tilsatte OH-ioner effektivt fjernes.
Bufferkapaciteten eller bufferkapaciteten bestemmer, hvor meget syre eller base en buffer kan neutralisere, før dens pH ændres væsentligt. Denne kapacitet afhænger af koncentrationerne af den svage syre og dens konjugerede base (eller den svage base og dens konjugerede syre) i bufferopløsningen. Buffere er essentielle i forskellige applikationer, herunder biologiske systemer (hvor pH er afgørende for enzymaktivitet), analytisk kemi (vedligeholdelse af en stabil pH til titreringer) og industrielle processer (kontrol af pH i fremstillingen).
 Varme artikler
Varme artikler
-
 Krystaller, der renser naturgasNår de er fjernet for forurenende stoffer, naturgas brænder meget mere rent end andre fossile brændstoffer. Kredit:© Yevhen Tarnavskyi/ Shutterstock, Inc. Fjernelse af de besværlige urenheder af s
Krystaller, der renser naturgasNår de er fjernet for forurenende stoffer, naturgas brænder meget mere rent end andre fossile brændstoffer. Kredit:© Yevhen Tarnavskyi/ Shutterstock, Inc. Fjernelse af de besværlige urenheder af s -
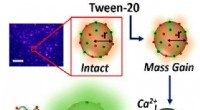 Forskere afslører, hvordan vaskemidler faktisk virkerGrafisk abstrakt. Kredit:The Journal of Physical Chemistry Letters (2022). DOI:10.1021/acs.jpclett.2c00704 Forskere har opdaget den præcise måde, hvorpå rengøringsmidler bryder biologiske membraner
Forskere afslører, hvordan vaskemidler faktisk virkerGrafisk abstrakt. Kredit:The Journal of Physical Chemistry Letters (2022). DOI:10.1021/acs.jpclett.2c00704 Forskere har opdaget den præcise måde, hvorpå rengøringsmidler bryder biologiske membraner -
 Højindeks overflade-eksponerede nanodendritter som ORR elektrokatalysatorVed hjælp af en atmosfære -skiftende strategi efterfulgt af elektrokemisk dealloying, forskere har syntetiseret sammensætningsgraderet PtCu 3 @Pt 3 Cu@Pt nanodendritter, der blotlægger overflader
Højindeks overflade-eksponerede nanodendritter som ORR elektrokatalysatorVed hjælp af en atmosfære -skiftende strategi efterfulgt af elektrokemisk dealloying, forskere har syntetiseret sammensætningsgraderet PtCu 3 @Pt 3 Cu@Pt nanodendritter, der blotlægger overflader -
 Et nyt peptid til hurtigt at dræbe multiresistente bakterierKonfokalmikroskopibillede af en klynge af A. baumannii-celler. Omega76 er farvet grøn, og ses interagere med membranen. Kredit:Indian Institute of Science Forskere ved Indian Institute of Science
Et nyt peptid til hurtigt at dræbe multiresistente bakterierKonfokalmikroskopibillede af en klynge af A. baumannii-celler. Omega76 er farvet grøn, og ses interagere med membranen. Kredit:Indian Institute of Science Forskere ved Indian Institute of Science
- Gennembrud tillader sporing af enkeltmolekyler i 3D med nanoskala-nøjagtighed
- Hvad fortæller slogans ved demonstrationer os?
- Hvad er et femtosekund i Hertz?
- NASA ser den tropiske cyklon Keni udvikle sig i det sydlige Stillehav
- Nyt design til hoppende og vingeflapende mikrorobotter
- Watchdog sagsøger FBI for ansigtsgenkendelseshemmelighed


