Gennembrud tillader sporing af enkeltmolekyler i 3D med nanoskala-nøjagtighed
En innovativ tilgang til kalibrering af højteknologiske mikroskoper gør det muligt for forskere at spore bevægelsen af enkeltmolekyler i 3D på nanoskalaen.
Et forskerhold fra Stanford University, ledet af W. E. Moerner, forlænger det arbejde, der gav Moerner og kollegerne Eric Betzig og Stefan W. Hell 2014 Nobelprisen i kemi. Betzig og Moerner var banebrydende for udviklingen af billedbehandling med superopløsning, som brød diffraktionsgrænsen for optisk mikroskopi ved at bruge fluorescensen af enkelte molekyler for første gang. Det nye værk, offentliggjort i The Optical Society's high impact journal Optica , viser en markant forbedring i nøjagtigheden af denne billeddannelsesteknik og til sporing af molekyler i tre dimensioner.
Sporing af, hvordan molekyler bevæger sig, danne former og interagere i kroppens celler og neuroner tilbyder et kraftfuldt nyt syn på vigtige biologiske processer såsom signalering, celledeling og neuronkommunikation, som alle påvirker folks helbred og modtagelighed for sygdomme.
Udnyttelse af en transformation i mikroskopi
Superopløselig mikroskopi bruger lasere til at excitere fluorescens fra enkelte molekyler under forhold, hvor kun få udsender ad gangen, overvinde den traditionelle opløsningsgrænse for optisk mikroskopi indstillet af diffraktionsgrænsen for lys.
"Med fremkomsten af superopløsningsbilleddannelse, vi forbedrede opløsningen med en faktor 5 til 10 ud over diffraktionsgrænsen - fra 200 nanometer ned til 40 eller endda 10 nanometer, "Moerner sagde." Denne nye verden med stærkt øget opløsning bringer en stor transformation i, hvordan det optiske system fungerer. "
Imidlertid, tidligere kalibreringsteknikker til superopløselig mikroskopi var ikke tilstrækkeligt præcise til 3D-målinger af enkeltmolekyler. Den nye kalibreringsmetode bruger et nanohulls array til at korrigere for optiske forvrængninger på tværs af et vidfeltmikroskops hele synsfelt.
Beskæftiger sig med forvrængning
Ved billeddannelse i skala af enkelte molekyler, et enkelt lyspunkt, der kommer fra et molekyle, kan typisk lokaliseres med omkring 10-nanometer præcision. Ved så høje opløsninger, enhver lille ufuldkommenhed i et optisk system indfører billedforvridninger, eller afvigelser, som markant kan skæve målinger, især i 3D. De resulterende fejl kan betyde forskellen mellem at tolke to molekyler som interagerende eller simpelthen være tæt på hinanden.
Mens mange bruger fluorescerende perler til at kalibrere 3D -mikroskoper, Alex von Diezmann, doktorand ved Moerner Lab, Stanford University, tog en anden tilgang. Han skabte en række huller i en metalfilm, hver mindre end 200 nanometer og med regelmæssig afstand på 2,5 mikron fra hinanden, at bruge som en 3D -kalibreringsstandard. Når hullerne var fyldt med fluorescerende farvestoffer, arrayet kunne bruges til at kalibrere for optiske fejl på tværs af hele mikroskopets synsfelt, ikke kun på få udvalgte steder, som muligt ved brug af fluorescerende perler. Ved hjælp af denne teknik, forskerne var i stand til at korrigere aberrationer på 50-100 nanometer til kun 25 nanometer.
"Før dette, folk havde ikke eksplicit bekymret sig over disse afvigelser, "sagde von Diezmann." Det faktum, at vi demonstrerede tilstedeværelsen af feltafhængige aberrationer, og viste, at de kunne nedbryde billeder, er en vigtig del af dette arbejde. "
Forskerne studerede den nye kalibreringsteknik med dobbelt-helix og astigmatisk punktspredningsfunktioner, to typer optisk modifikation, der typisk bruges til at udtrække z-aksens placering. Selvom begge punktspredningsfunktioner viste z-akse-relaterede unøjagtigheder, der skabte omkring 20 procent fejl i 3D-målingerne, forskerne rettede disse afvigelser ved hjælp af 3D nanohole array.
Demonstrerende fordele ved undersøgelse af proteiner i bakterier
Forskerne anvender nu den nye 3D-kalibreringsteknik til alle deres enkeltmolekylære sporings- og superopløsningsmikroskopistudier. For eksempel, von Diezmann bruger det til at studere proteinlokalisering i bakterier, der kun måler to mikrometer. Med 3D -kalibreringsteknikken, han kan nøjagtigt måle og spore nøglesignalproteiner i nanodomæner, der kun er 150 til 200 nanometer store.
Forskerne påpeger, at korrektion af feltafhængige og andre former for afvigelser bliver mere og mere vigtig, efterhånden som optiske mikroskopiteknikker udvikler sig til billedet dybere ind i celler, for eksempel.
"Vi studerede denne tilgang i et par tilfælde, men det kan bruges med enhver superopløsning eller lokaliseringsmikroskopi, der kræver virkelig præcise 3D-målinger, "sagde von Diezmann." Det bliver spændende at se andre grupper bruge det til at finde ud af, hvordan deres særlige teknik påvirkes af feltafhængige aberrationer. Som et fællesskab, måske kan vi finde endnu bedre måder at håndtere disse afvigelser på. "
Forskere producerede et 3D -kalibreringsværktøj ved at oprette en vifte af nanoskalahuller fyldt med fluorescerende farvestof. I en), vidfeltbelysning (grøn) passerer gennem glasdækslet til et nanohul ætset i et lag aluminium. Opløsningen af fluorescerende farvestof fylder hullerne, og de resulterende lyspunkter (orange) detekteres nedenunder. Figure (b) shows a scanning electron microscope image of the holes, which are each 200 nanometers or less in diameter.
Sidste artikelLøsning af global opvarmning med nanoporøse materialer
Næste artikelForskere designer og patenterer grafenbiosensorer
 Varme artikler
Varme artikler
-
 Gelatin nanopartikler kunne levere medicin til hjernenIllinois -professor Kyekyoon “Kevin” Kim, kandidatstuderende Elizabeth Joachim og forsker Hyungsoo Choi udviklede små gelatine nanopartikler, der kan transportere medicin til hjernen, hvilket kunne fø
Gelatin nanopartikler kunne levere medicin til hjernenIllinois -professor Kyekyoon “Kevin” Kim, kandidatstuderende Elizabeth Joachim og forsker Hyungsoo Choi udviklede små gelatine nanopartikler, der kan transportere medicin til hjernen, hvilket kunne fø -
 Forskere foreslår en ny tilgang til effektiv nanomaterialemodelleringForskere foreslog en ny tilgang til effektiv modellering af nanomaterialer. Kredit:Peter den Store St.Petersburg Polytechnic University Forskere fra Higher School of Theoretical Mechanics ved Pete
Forskere foreslår en ny tilgang til effektiv nanomaterialemodelleringForskere foreslog en ny tilgang til effektiv modellering af nanomaterialer. Kredit:Peter den Store St.Petersburg Polytechnic University Forskere fra Higher School of Theoretical Mechanics ved Pete -
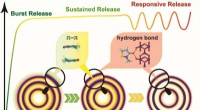 Temporal-spatial ordensegenskab for hule flerskallede strukturer muliggør sekventiel frigivelse af …Skematisk illustration af den sekventielle lægemiddelfrigivelse ved hjælp af hul flerskallet struktur. Kredit:Yang Nailiang Hule flerskallede strukturer (HoMSer), med relativt isolerede hulrum og
Temporal-spatial ordensegenskab for hule flerskallede strukturer muliggør sekventiel frigivelse af …Skematisk illustration af den sekventielle lægemiddelfrigivelse ved hjælp af hul flerskallet struktur. Kredit:Yang Nailiang Hule flerskallede strukturer (HoMSer), med relativt isolerede hulrum og -
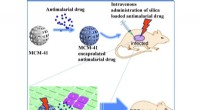 Banebrydende antimalaria-lægemiddelleveringssystem ved hjælp af mesoporøse silicananopartiklerForskere fra Kumamoto University fandt ud af, at brug af MCM-41 som et lægemiddelleveringssystem til malariabehandling gav en yderst effektiv behandling hos dyr. Kliniske forsøg er planlagt i den nærm
Banebrydende antimalaria-lægemiddelleveringssystem ved hjælp af mesoporøse silicananopartiklerForskere fra Kumamoto University fandt ud af, at brug af MCM-41 som et lægemiddelleveringssystem til malariabehandling gav en yderst effektiv behandling hos dyr. Kliniske forsøg er planlagt i den nærm
- Regular Lights Vs. Laser Lights
- Japan modstandsdygtig, men klimaforandringer gør katastrofer værre:eksperter
- Det overraskende omfang af Kinas rumprogram
- Verdens mest komplekse mikropartikel:Et syntetisk materiale, der overgår naturens forviklinger (Opd…
- Hvordan følelser former arbejdslivet
- Kedsomhedens fascinerende historie


