Hvorfor afbalancerer vi kemiske ligninger?
For at afbalancere en kemisk ligning tilføjes koefficienter til reaktanterne og produkterne. Disse koefficienter repræsenterer det relative antal molekyler eller mol af hvert stof involveret i reaktionen. For eksempel ligningen
$$2H_2 + O_2 \højrepil 2H_2O$$
er afbalanceret, fordi der er det samme antal brintatomer (4) og oxygenatomer (2) på begge sider af ligningen.
Afbalancering af kemiske ligninger kan være udfordrende, især for komplekse reaktioner. Der er dog en række metoder, der kan bruges til at forenkle processen. En almindelig metode er at starte med at afbalancere de grundstoffer, der kun forekommer i én reaktant eller produkt. Når disse elementer er afbalanceret, kan de resterende elementer lettere afbalanceres.
En anden metode, der kan bruges til at afbalancere kemiske ligninger, er at bruge kryds og tværs-metoden. Denne metode involverer at multiplicere koefficienten for hver reaktant med subskriptet af det tilsvarende element i produktet og omvendt. For eksempel i ligningen
$$2H_2 + O_2 \højrepil 2H_2O$$
koefficienten for H2 er 2, og underskriften af H i H2O er 2. Derfor er koefficienten for H2O 2 × 2 =4.
Afbalancering af kemiske ligninger er en vigtig færdighed for kemikere og andre videnskabsmænd. Det er et nødvendigt skridt i at forstå og forudsige resultatet af kemiske reaktioner.
 Varme artikler
Varme artikler
-
 Forskere adskiller protein-nanopartikel-interaktioner, foreslå vej til lægemiddel-sensing værktø…Arbejde fra videnskabsmænd ved Rice og Stanford universiteter afslørede, at bovint serumalbuminproteiner får guld nanorods til at danne højrehåndede chirale samlinger, mens de producerer chirale plasm
Forskere adskiller protein-nanopartikel-interaktioner, foreslå vej til lægemiddel-sensing værktø…Arbejde fra videnskabsmænd ved Rice og Stanford universiteter afslørede, at bovint serumalbuminproteiner får guld nanorods til at danne højrehåndede chirale samlinger, mens de producerer chirale plasm -
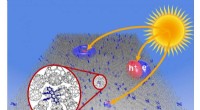 Molekylære vibrationer reducerer den maksimalt opnåelige fotovoltage i organiske solcellerIllustration af generation af ladningspar (excitoner), forløberne til gratis ladningsbærere i det aktive lag af en organisk solcelle. Kredit:Technische Universitaet Dresden Forskere ved TU Dresden
Molekylære vibrationer reducerer den maksimalt opnåelige fotovoltage i organiske solcellerIllustration af generation af ladningspar (excitoner), forløberne til gratis ladningsbærere i det aktive lag af en organisk solcelle. Kredit:Technische Universitaet Dresden Forskere ved TU Dresden -
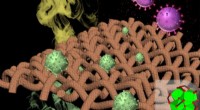 En sjælden bedrift:Materiale beskytter mod både biologiske og kemiske truslerProgrammerbar krystallinsk svamp-tekstil komposit til eliminering af biologiske og kemiske trusler. Kredit:Northwestern University Et forskningshold fra Northwestern University har udviklet et als
En sjælden bedrift:Materiale beskytter mod både biologiske og kemiske truslerProgrammerbar krystallinsk svamp-tekstil komposit til eliminering af biologiske og kemiske trusler. Kredit:Northwestern University Et forskningshold fra Northwestern University har udviklet et als -
 Fotoinitiatorer til tandfyldninger, kontaktlinser og tandproteserForskere ved Graz University of Technology har udviklet en ny, væsentligt billigere produktionsmetode for germanium-baserede fotoinitiatorer. Dette åbner op for yderligere anvendelsesområder ud over d
Fotoinitiatorer til tandfyldninger, kontaktlinser og tandproteserForskere ved Graz University of Technology har udviklet en ny, væsentligt billigere produktionsmetode for germanium-baserede fotoinitiatorer. Dette åbner op for yderligere anvendelsesområder ud over d
- En guide til meteorregn – hvad skal man passe på og hvornår
- Når det kommer til biologiske populationer, Forvent det uventede
- Olie og Arktis:hvad er på spil
- Når forbrugerne vil have plastik, men også bekymre dig om planeten
- Forskere kæmper for at redde havgræs fra kystforurening
- Nyt gennembrud åbner døre til behandling af melanin-relaterede hudsygdomme


