Er mol sølvioner i vand lig med mol nitratopløsning?
Ved lave koncentrationer opløses sølvnitrat fuldstændigt i sølvioner (Ag+) og nitrationer (NO3-). Molerne af sølvioner i opløsning er derfor lig med molerne af nitrationer.
Men når koncentrationen af sølvnitrat stiger, falder opløseligheden af forbindelsen. Det betyder, at en mindre del af sølvnitratmolekylerne dissocierer til ioner. Som et resultat bliver mol sølvioner i opløsning mindre end mol nitrationer.
Det nøjagtige forhold mellem mol af sølvioner og nitrationer i opløsning kan bestemmes ved hjælp af en opløselighedskurve. En opløselighedskurve viser den maksimale mængde af opløst stof, der kan opløses i et opløsningsmiddel ved en given temperatur. Sølvnitrats opløselighed i vand ved 25°C er ca. 220 g/L. Det betyder, at en opløsning, der indeholder mere end 220 g sølvnitrat pr. liter, vil blive mættet, og eventuelt overskydende sølvnitrat vil fælde ud af opløsningen som et fast stof.
Opløselighedskurven for sølvnitrat viser også, at opløseligheden af forbindelsen stiger, når temperaturen stiger. Det betyder, at en varm opløsning af sølvnitrat kan opløse mere opløst stof end en kold opløsning.
 Varme artikler
Varme artikler
-
 Glykaner som biomarkører for kræft?Kredit:Wiley Glykosylerede proteiner er ofte overudtrykt i tumorceller og kan derfor tjene som tumormarkører, især dem med det interessante molekyle sialinsyre som sukkerdel. I journalen Angewand
Glykaner som biomarkører for kræft?Kredit:Wiley Glykosylerede proteiner er ofte overudtrykt i tumorceller og kan derfor tjene som tumormarkører, især dem med det interessante molekyle sialinsyre som sukkerdel. I journalen Angewand -
 Moderne alkymi skaber selvlysende jernmolekylerKredit:Lunds Universitet En gruppe forskere ved Lunds Universitet i Sverige har lavet det første jernbaserede molekyle, der er i stand til at udsende lys. Dette kunne bidrage til udviklingen af
Moderne alkymi skaber selvlysende jernmolekylerKredit:Lunds Universitet En gruppe forskere ved Lunds Universitet i Sverige har lavet det første jernbaserede molekyle, der er i stand til at udsende lys. Dette kunne bidrage til udviklingen af -
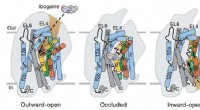 Behandling af afhængighed:Cryo-EM-teknologien muliggør det umuligeMekanismer for transport og virkning af ibogain. Tegneserie, der skildrer konformationelle forskelle mellem udadtil-åbne, okkluderede og indad-åbne konformationer. Ibogain hæmmer SERT enten ved at bin
Behandling af afhængighed:Cryo-EM-teknologien muliggør det umuligeMekanismer for transport og virkning af ibogain. Tegneserie, der skildrer konformationelle forskelle mellem udadtil-åbne, okkluderede og indad-åbne konformationer. Ibogain hæmmer SERT enten ved at bin -
 Observation af brinteffekter i metalDenne illustration viser hovedelementerne i det system, holdet brugte:Den flerfarvede plade i midten er det metallag, der studeres, det lyseblå område til venstre er elektrolytopløsningen, der bruges
Observation af brinteffekter i metalDenne illustration viser hovedelementerne i det system, holdet brugte:Den flerfarvede plade i midten er det metallag, der studeres, det lyseblå område til venstre er elektrolytopløsningen, der bruges
- Håndtering af et tabu:Bringer jagt og fiskeri os tættere på naturen?
- Flydende krystallers overraskende styrke
- Ser på, hvordan genopladelige lithium-ion-batterier fungerer
- Overvågning af elektrisk strøm giver høj præcision, sensorfri midler til at styre ventiler og lå…
- På frontlinjen i Kilauea
- Undersøgelse finder, at overkommelighed, ikke infrastruktur, er en stor barriere for højhastigheds…


