Hvordan reagerer ionforbindelser i vand?
Ioniseringen af ioniske forbindelser i vand kan forklares ved hjælp af begrebet polære molekyler. Vand er et polært molekyle, hvilket betyder, at det har en let positiv ende (brintatomerne) og en lidt negativ ende (iltatomet). Disse polære vandmolekyler interagerer med ionerne i den ioniske forbindelse gennem elektrostatiske kræfter.
Den positive ende af vandmolekylerne tiltrækker de negative ioner (anioner) af forbindelsen, mens den negative ende af vandmolekylerne tiltrækker de positive ioner (kationer). Denne tiltrækning fører til adskillelse af ionerne fra hinanden og deres spredning i vandet.
I hvilket omfang en ionforbindelse dissocierer i vand afhænger af flere faktorer, herunder arten af de involverede ioner, koncentrationen af opløsningen og temperaturen. Generelt har ioniske forbindelser med højt ladede ioner og små radier en tendens til at dissociere lettere i vand. Derudover fremmer højere temperaturer og lavere koncentrationer ioniseringen af ioniske forbindelser.
Ioniseringen af ioniske forbindelser i vand har flere vigtige konsekvenser:
1. Danning af ioner: Adskillelsen af ioner i kationer og anioner skaber en opløsning af frie ioner, som kan deltage i forskellige kemiske reaktioner og lede elektricitet.
2. Hydrering af ioner: Vandmolekylerne omgiver ionerne og danner hydreringsskaller. Disse hydreringsskaller stabiliserer ionerne og forhindrer dem i at rekombinere.
3. Koligative egenskaber: Tilstedeværelsen af opløste ioner i vand påvirker opløsningens kolligative egenskaber, såsom kogepunktsforhøjelse, frysepunktsdepression og osmotisk tryk.
4. Kemiske reaktioner: De ioner, der dannes ved ionisering af ioniske forbindelser, kan reagere med andre ioner eller molekyler, der er til stede i vandet, hvilket fører til dannelsen af nye forbindelser og letter forskellige kemiske reaktioner.
Overordnet set spiller ioniseringen af ioniske forbindelser i vand en afgørende rolle i deres adfærd, reaktivitet og egenskaberne af de resulterende opløsninger.
 Varme artikler
Varme artikler
-
 Udvikling af cellulær membran-FET (lipid-FET) til følsomhed af biosensorUdfordringer til potentiometriske måleordninger til molekylær detektion på en FET under ionisk miljø:dannelse af EDL, uspecifik binding, og tilfældigt orienterede receptorer. Kredit:Korea Institute of
Udvikling af cellulær membran-FET (lipid-FET) til følsomhed af biosensorUdfordringer til potentiometriske måleordninger til molekylær detektion på en FET under ionisk miljø:dannelse af EDL, uspecifik binding, og tilfældigt orienterede receptorer. Kredit:Korea Institute of -
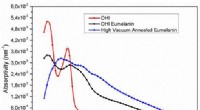 Vil cyborgs blive lavet af melanin? Pigmentgennembrud muliggør biokompatibel elektronikUV-Vis absorptionsevne (procent absorbans/filmtykkelse) af filmene på de forskellige procestrin:(rød, cirkler) DHI; (sort, firkanter) DHI-eumelanin (film efter AISSP); (blå, trekanter) HVAE (film efte
Vil cyborgs blive lavet af melanin? Pigmentgennembrud muliggør biokompatibel elektronikUV-Vis absorptionsevne (procent absorbans/filmtykkelse) af filmene på de forskellige procestrin:(rød, cirkler) DHI; (sort, firkanter) DHI-eumelanin (film efter AISSP); (blå, trekanter) HVAE (film efte -
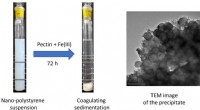 Interaktion mellem nanoplast og pektin, et vandopløseligt polysaccharidVenstre billede:Billedet af en nano-polystyrensuspension (500 mg L−1, pH 7) (venstre) og nanopolystyrensuspensionen efter tilsætning af pektin (15 mg L−1) og Fe(III) (0,10 mM) efter opbevaring i 72 ti
Interaktion mellem nanoplast og pektin, et vandopløseligt polysaccharidVenstre billede:Billedet af en nano-polystyrensuspension (500 mg L−1, pH 7) (venstre) og nanopolystyrensuspensionen efter tilsætning af pektin (15 mg L−1) og Fe(III) (0,10 mM) efter opbevaring i 72 ti -
 Kan atomkraft bekæmpe klimaændringer?Kredit:CC0 Public Domain For at afbøde klimaændringer, andelen af lavemissionselektricitetsproduktion skal stige fra nutidens 36 % til 85 % i 2040, siger det internationale energiagentur (IEA).
Kan atomkraft bekæmpe klimaændringer?Kredit:CC0 Public Domain For at afbøde klimaændringer, andelen af lavemissionselektricitetsproduktion skal stige fra nutidens 36 % til 85 % i 2040, siger det internationale energiagentur (IEA).
- Hvorfor vi ser håb for fremtiden for videnskabsjournalistik
- Kan smartphones besvare dit opkald om hjælp?
- Har klimaskeptikere ret?
- Hvordan billedsprog og mediedækning påvirker vores empati for fremmede
- Hoteller, der promoverer kvinder, der opfattes som mere retfærdige, mindre diskriminerende
- Hvad driver os til at være anonyme online?


