Hvorfor er natriumchlorid uopløseligt i ethylalkohol?
Når natriumchlorid er opløst i vand, omgiver vandmolekylerne ionerne og opløser dem, hvilket betyder, at de danner et lag af vandmolekyler omkring hver ion. Denne opløsningsproces svækker de elektrostatiske kræfter mellem ionerne, så de kan adskilles og opløses i vandet.
I modsætning hertil er ethylalkohol ikke i stand til at opløse natriumchloridioner så effektivt som vand. Det skyldes, at ethylalkoholmolekylerne ikke er så polære som vandmolekyler, så de danner ikke så stærke brintbindinger med ionerne. Som følge heraf er de elektrostatiske kræfter mellem ionerne ikke svækket nok til at tillade dem at adskille og opløses i ethylalkoholen.
Derfor er natriumchlorid uopløseligt i ethylalkohol.
Sidste artikelHvornår reagerer syrer med metaller?
Næste artikelHvad indikerer pH 7?
 Varme artikler
Varme artikler
-
 Indtageligt medicinsk udstyr kan brydes ned med lysLet nedbrydelige hydrogeler som dynamiske triggere i GI-enheder. (A) Skematisk af ballonindsættelse og inflation (venstre), nedbrydning via enten en endoskopisk eller usammenhængende LED lyskilde (mid
Indtageligt medicinsk udstyr kan brydes ned med lysLet nedbrydelige hydrogeler som dynamiske triggere i GI-enheder. (A) Skematisk af ballonindsættelse og inflation (venstre), nedbrydning via enten en endoskopisk eller usammenhængende LED lyskilde (mid -
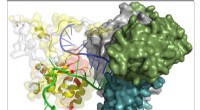 Forskere undersøger strukturen i en nøgleregion af langtidsprotein -telomeraseModel af telomerase katalytisk underenhed af H. polymorpha med fragmenter af telomerase RNA og telomert DNA. Rester, der deltager i bindingen af oligonukleotider, er markeret med rødt i TED-domæne
Forskere undersøger strukturen i en nøgleregion af langtidsprotein -telomeraseModel af telomerase katalytisk underenhed af H. polymorpha med fragmenter af telomerase RNA og telomert DNA. Rester, der deltager i bindingen af oligonukleotider, er markeret med rødt i TED-domæne -
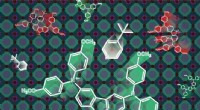 Forskere rapporterer teknik til at forlænge levetiden for perovskite solcellerKredit:Vytautas Getautis et al. fra J. Mater. Chem. C, 2018, 6, 8874–8878 En gruppe kemikere ved Kaunas University of Technology (KTU), Litauen, sammen med fysikerne fra Vilnius University og det
Forskere rapporterer teknik til at forlænge levetiden for perovskite solcellerKredit:Vytautas Getautis et al. fra J. Mater. Chem. C, 2018, 6, 8874–8878 En gruppe kemikere ved Kaunas University of Technology (KTU), Litauen, sammen med fysikerne fra Vilnius University og det -
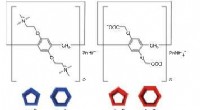 Selvsortering gennem molekylære geometrierStrukturer af søjle [n] arenaer, n =5 og 6. Venstre, blå:kationiske (positivt ladede) varianter; ret, rød:anioniske (negativt ladede) varianter. Kredit:Kanazawa University Forskere ved Kanazawa Un
Selvsortering gennem molekylære geometrierStrukturer af søjle [n] arenaer, n =5 og 6. Venstre, blå:kationiske (positivt ladede) varianter; ret, rød:anioniske (negativt ladede) varianter. Kredit:Kanazawa University Forskere ved Kanazawa Un


