Hvis 0,500 mol af et ikke-elektrolyt opløst stof er opløst i 500,0 g ether, hvad er frysepunktsopløsningen?
$$\Delta T_f =K_f \ gange m$$
Hvor:
- \(\Delta T_f\) er frysepunktets depression
- \(K_f\) er opløsningsmidlets kryoskopiske konstant
- \(m\) er opløsningens molalitet
I dette tilfælde er opløsningsmidlet ether, som har en \(K_f\) værdi på 2,25 °C/m. Opløsningens molalitet er:
$$m =\frac{\text{mol opløst stof}}{\text{kilogram opløsningsmiddel}}$$
Vi har 0,500 mol opløst stof og 500,0 g opløsningsmiddel. For at omregne gram til kilogram dividerer vi med 1000:
$$m =\frac{0,500 \text{ mol}}{0,500 \text{ kg}} =1,00 \text{ m}$$
Nu kan vi erstatte værdierne af \(K_f\) og \(m\) i ligningen for \(\Delta T_f\):
$$\Delta T_f =2,25 \text{ °C/m} \ gange 1,00 \text{ m} =2,25 \text{ °C}$$
Opløsningens frysepunkt er derfor 2,25 °C lavere end frysepunktet for ren ether.
 Varme artikler
Varme artikler
-
 Ny proces omdanner biomasseaffald til nyttige elektroniske enhederPhoenix træ ( Paulownia imperialis ) blade. Kredit:US National Park Service, Offentligt domæne Det nordlige Kinas vejkanter er krydret med løvfældende føniks træer, producerer en overflod af ned
Ny proces omdanner biomasseaffald til nyttige elektroniske enhederPhoenix træ ( Paulownia imperialis ) blade. Kredit:US National Park Service, Offentligt domæne Det nordlige Kinas vejkanter er krydret med løvfældende føniks træer, producerer en overflod af ned -
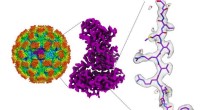 Norovirusstrukturer kan hjælpe med at udvikle behandlinger mod madforgiftningZoomer ind på norovirusstrukturen ved nær atomare detaljer Kredit:Joshua-Tor lab/CSHL 2019 Norovirus er en førende årsag til fødevarebårne sygdomsudbrud, tegner sig for 58 % af alle udbrud og forå
Norovirusstrukturer kan hjælpe med at udvikle behandlinger mod madforgiftningZoomer ind på norovirusstrukturen ved nær atomare detaljer Kredit:Joshua-Tor lab/CSHL 2019 Norovirus er en førende årsag til fødevarebårne sygdomsudbrud, tegner sig for 58 % af alle udbrud og forå -
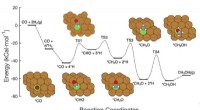 Machine learning framework ID'er mål til forbedring af katalysatorerDenne grafik viser syvtrins reaktionsvejen for CO-hydrogenering til methanol over kobberbaserede katalysatorer, inklusive reaktanterne på hvert trin, skematiske atomarrangementer af mellemprodukterne
Machine learning framework ID'er mål til forbedring af katalysatorerDenne grafik viser syvtrins reaktionsvejen for CO-hydrogenering til methanol over kobberbaserede katalysatorer, inklusive reaktanterne på hvert trin, skematiske atomarrangementer af mellemprodukterne -
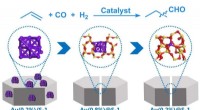 Forskere udvikler en ny Au-katalysator til hydroformyleringStrukturel modellering og ydelsessammenligning af Au-baserede katalysatorer. Kredit:SARI Som en af de største industrielle kemiske processer i dag, omdanner hydroformylering olefiner, H2 og CO ti
Forskere udvikler en ny Au-katalysator til hydroformyleringStrukturel modellering og ydelsessammenligning af Au-baserede katalysatorer. Kredit:SARI Som en af de største industrielle kemiske processer i dag, omdanner hydroformylering olefiner, H2 og CO ti


