Hvad er forskellen mellem ikoniske og kovalente bindinger?
1. Elektronoverførsel vs. deling:
- Ionisk binding: I en ionbinding overføres elektroner fra et atom til et andet, hvilket resulterer i dannelsen af positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Den elektrostatiske tiltrækning mellem disse ioner holder sammensætningen sammen.
- Kovalent binding: I en kovalent binding deles elektroner mellem atomer. Begge atomer bidrager med elektroner til at danne et stabilt elektronpar, der er placeret i mellemrummet mellem kernerne. Dette delte elektronpar er grundlaget for den kovalente binding.
2. Elektronegativitetsforskel:
- Ionisk binding: Ionbindinger opstår, når der er en signifikant forskel i elektronegativitet mellem de involverede atomer. Elektronegativitet måler et atoms evne til at tiltrække elektroner. En stor forskel i elektronegativitet betyder, at et atom stærkt tiltrækker elektroner, hvilket fører til elektronoverførsel og dannelse af ioner.
- Kovalent binding: Kovalente bindinger dannes, når elektronegativitetsforskellen mellem atomer er relativt lille. Elektronerne deles mere ligeligt, og der er ingen fuldstændig overførsel af elektroner.
3. Elektrisk ledningsevne:
- Ionisk forbindelse: Ioniske forbindelser er generelt gode ledere af elektricitet, når de opløses i vand eller smeltes. Dette skyldes, at ionerne kan bevæge sig frit i opløsning eller smeltet tilstand og bære den elektriske strøm.
- Kovalent forbindelse: Kovalente forbindelser er typisk dårlige ledere af elektricitet. Da elektronerne er lokaliseret i kovalente bindinger og ikke kan bevæge sig frit, kan de ikke føre en elektrisk strøm.
4. Opløselighed:
- Ionisk forbindelse: Ioniske forbindelser er ofte opløselige i polære opløsningsmidler, såsom vand. De polære opløsningsmiddelmolekyler kan omgive og opløse ionerne, bryde de elektrostatiske attraktioner mellem dem og tillade forbindelsen at opløses.
- Kovalent forbindelse: Kovalente forbindelser er generelt uopløselige i polære opløsningsmidler, men kan være opløselige i ikke-polære opløsningsmidler. Ikke-polære opløsningsmidler interagerer ikke stærkt med de kovalente bindinger og kan opløse kovalente forbindelser.
5. Bindingsstyrke:
- Ionisk binding: Ionbindinger er generelt stærkere end kovalente bindinger på grund af den stærke elektrostatiske tiltrækning mellem modsat ladede ioner.
- Kovalent binding: Kovalente bindinger kan variere i styrke afhængigt af de involverede atomer og antallet af delte elektronpar. Nogle kovalente bindinger er stærkere end andre.
6. Smelte- og kogepunkter:
- Ionisk forbindelse: Ioniske forbindelser har en tendens til at have højere smelte- og kogepunkter sammenlignet med kovalente forbindelser. De stærke ioniske interaktioner kræver en betydelig mængde energi at overvinde for at smelte eller koge forbindelsen.
- Kovalent forbindelse: Kovalente forbindelser har generelt lavere smelte- og kogepunkter sammenlignet med ioniske forbindelser. De svagere kovalente bindinger kræver mindre energi at bryde, hvilket resulterer i lavere smelte- og kogepunkter.
Sammenfattende involverer ionbindinger overførsel af elektroner og resulterer i dannelsen af ioner, mens kovalente bindinger involverer deling af elektroner mellem atomer. Forskellene i elektronegativitet, elektrisk ledningsevne, opløselighed, bindingsstyrke og smelte-/kogepunkter hjælper med at skelne mellem ioniske og kovalente bindinger.
 Varme artikler
Varme artikler
-
 Afdækning af et manglende led fra metan til methanolDette billede viser den selektive funktionalisering af metanmolekyler, en kemisk proces, der gør dem mere teknologisk eftertragtede. Metanmolekylerne er vist som ét gråt kulstofatom forbundet med fire
Afdækning af et manglende led fra metan til methanolDette billede viser den selektive funktionalisering af metanmolekyler, en kemisk proces, der gør dem mere teknologisk eftertragtede. Metanmolekylerne er vist som ét gråt kulstofatom forbundet med fire -
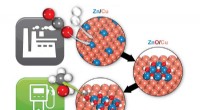 Chemists ID katalytisk nøgle til omdannelse af CO2 til methanolBrookhaven-forskere har identificeret, hvordan en zink/kobber (Zn/Cu) katalysator omdanner kuldioxid (to røde og en grå kugler) og brint (to hvide kugler) til methanol (en grå, en rød, og fire hvide k
Chemists ID katalytisk nøgle til omdannelse af CO2 til methanolBrookhaven-forskere har identificeret, hvordan en zink/kobber (Zn/Cu) katalysator omdanner kuldioxid (to røde og en grå kugler) og brint (to hvide kugler) til methanol (en grå, en rød, og fire hvide k -
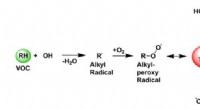 Identifikation af et undvigende molekyle nøgle til forbrændingskemiEt diagram, der viser, hvordan oxidationen af flygtige organiske forbindelser (VOC) kan forbruge og regenerere OH-radikaler. Et alkylradikal (R•) reagerer med oxygen og danner et alkylperoxyradikal
Identifikation af et undvigende molekyle nøgle til forbrændingskemiEt diagram, der viser, hvordan oxidationen af flygtige organiske forbindelser (VOC) kan forbruge og regenerere OH-radikaler. Et alkylradikal (R•) reagerer med oxygen og danner et alkylperoxyradikal -
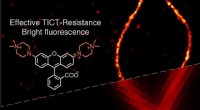 Oplyser vejen til superopløsningsbilleddannelse med forbedrede rhodaminfarvestofferForskere fra DUT og SUTD udviklede en ny klasse af kvaternære piperazin-substituerede rhodaminer med fremragende kvanteudbytter (Φ =0,93) og overlegen lysstyrke (ε × Φ =8,1 × 104 L·mol-1·cm-1), til bi
Oplyser vejen til superopløsningsbilleddannelse med forbedrede rhodaminfarvestofferForskere fra DUT og SUTD udviklede en ny klasse af kvaternære piperazin-substituerede rhodaminer med fremragende kvanteudbytter (Φ =0,93) og overlegen lysstyrke (ε × Φ =8,1 × 104 L·mol-1·cm-1), til bi
- Forudsigelsesværktøj viser, hvordan skovudtynding kan øge Sierra Nevada snesæk
- Er gasafgiftsferie en frygtelig idé? Denne økonom siger ja
- Spintronics-forskning viser, at materialets magnetiske egenskaber kan forudsige, hvordan en spinstrø…
- Forskere analyserer flokadfærd på buede overflader
- Højere niveauer af fødevarefattigdom under COVID vil sandsynligvis forblive, viser ny forskning
- Tæt adskilte hydrogenatomer kunne lette superledning i omgivelsesbetingelser


