Hvad sker der med kobber 2-sulfat, når det opvarmes?
1. Under 100°C:Ved opvarmning til under 100°C mister kobber(II)sulfat vandmolekyler i en proces kaldet dehydrering. Hydratmolekylerne i kobber(II)sulfatpentahydrat (CuSO4·5H2O), den mest almindelige form, begynder at fordampe som vanddamp, hvilket fører til dannelsen af den mono- eller vandfri form (CuSO4). Dette kan ses, da de blå krystaller begynder at blive hvide og bliver pulveragtige på grund af vandtab.
2. Omkring 200°C:Efterhånden som temperaturen øges yderligere, omkring 200°C, undergår det vandfri kobber(II)sulfat nedbrydning. Denne proces involverer nedbrydning af kobber-sulfatbindinger og frigivelse af forskellige gasser. Nedbrydningsprodukterne omfatter svovldioxid (SO2) gas, svovltrioxid (SO3) gas og oxygen (O2) gas.
3. Over 625°C:Ved temperaturer over 625°C nedbrydes kobber(II)sulfat fuldstændigt og efterlader kobberoxid (CuO) som en fast rest. Kobberoxid er et sort pulver, der yderligere kan nedbrydes til kobbermetal og iltgas ved meget høje temperaturer.
De kemiske reaktioner, der opstår under opvarmningen af kobber(II)sulfat, kan opsummeres som følger:
CuSO4·5H2O (under 100°C) → CuSO4 + 5H2O (damp)
CuSO4 (omkring 200°C) → CuO + SO2 + SO3 + O2
CuO (over 625°C) → Cu + O2
Det er vigtigt at bemærke, at de nøjagtige temperaturer, ved hvilke disse reaktioner forekommer, kan variere lidt afhængigt af de specifikke forhold, såsom opvarmningshastighed, tryk og tilstedeværelsen af urenheder. Opvarmning af kobber(II)sulfat bør udføres i et godt ventileret område for at undgå eksponering for skadelige gasser, der frigives under nedbrydning.
Sidste artikelOpløses kobbersulfat i vand?
Næste artikelHvilken slags reaktion er repræsenteret her caco3 plus h2so4 caso4 h2 co2?
 Varme artikler
Varme artikler
-
 Fokusering på iltreduktionsreaktionen i søgen efter mere effektive brintcellerKredit:Leiden University En ihærdig postdoc-forsker overtalte professor Marc Koper til at forske i iltreduktionsreaktionen. I Kopers øjne var der lidt interesse der. Men de opdagede straks en helt
Fokusering på iltreduktionsreaktionen i søgen efter mere effektive brintcellerKredit:Leiden University En ihærdig postdoc-forsker overtalte professor Marc Koper til at forske i iltreduktionsreaktionen. I Kopers øjne var der lidt interesse der. Men de opdagede straks en helt -
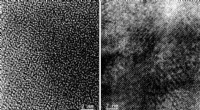 Forskere bruger en ny metode til at lave lovende batterimaterialeBilleder fremstillet ved transmissionselektronmikroskopi bekræftede transformationen af elektrodematerialet fra et uordnet arrangement af atomer (til venstre) til en ordnet, krystallinsk struktur (h
Forskere bruger en ny metode til at lave lovende batterimaterialeBilleder fremstillet ved transmissionselektronmikroskopi bekræftede transformationen af elektrodematerialet fra et uordnet arrangement af atomer (til venstre) til en ordnet, krystallinsk struktur (h -
 Vinpolyfenoler kan afværge bakterier, der forårsager huller og tandkødssygdommeKredit:CC0 Public Domain At nippe til vin er godt for dit tyktarm og hjerte, muligvis på grund af drikkevarens rigelige og strukturelt forskellige polyfenoler. Nu rapporterer forskere i ACS Tidss
Vinpolyfenoler kan afværge bakterier, der forårsager huller og tandkødssygdommeKredit:CC0 Public Domain At nippe til vin er godt for dit tyktarm og hjerte, muligvis på grund af drikkevarens rigelige og strukturelt forskellige polyfenoler. Nu rapporterer forskere i ACS Tidss -
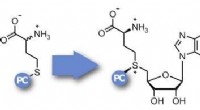 Enzymatisk photocaging til undersøgelse af genregulering gennem DNA-methyleringKredit:Wiley Tilføjelse og fjernelse af methylgrupper på DNA spiller en vigtig rolle i genregulering. For at studere disse mekanismer mere præcist, et tysk team har udviklet en ny metode, hvorved
Enzymatisk photocaging til undersøgelse af genregulering gennem DNA-methyleringKredit:Wiley Tilføjelse og fjernelse af methylgrupper på DNA spiller en vigtig rolle i genregulering. For at studere disse mekanismer mere præcist, et tysk team har udviklet en ny metode, hvorved
- Raman og infrarød spektroskopi hjælper med at identificere forskellige acetylerede lysiner
- Når atomer kombinerer, kaldes tiltrækningskraften dem sammen?
- Hvorfor er alkalimetallers smelte- og kogepunkt lavere sammenlignet med jordalkalimetaller?
- Omkostninger ved den 20-årige krig mod terror:8 billioner dollars og 900,- 000 dødsfald
- Fordele og ulemper ved metoder til kvadratiske ligninger
- Argentina viser en 65 millioner år gammel dinosaur-replika


