Hvad er hybridisering af Be i BeH2?
Hybridiseringen af Be i BeH2 kan forstås ved hjælp af valensbindingsteori. I denne teori kombineres de deltagende atomers atomare orbitaler for at danne hybridorbitaler, der har den passende symmetri til at overlappe med de andre atomers orbitaler og danner kemiske bindinger.
I tilfælde af BeH2 har berylliumatomet to valenselektroner, en i 2s orbital og en i 2p orbital. 2s orbital er kugleformet, mens 2p orbital er håndvægtformet med lapper orienteret langs x-, y- og z-akserne.
Når BeH2 dannes, hybridiserer 2s og 2p orbitaler af beryllium for at danne to sp hybrid orbitaler. Disse sp hybrid orbitaler er rettet på en lineær måde med en vinkel på 180 grader mellem dem. Dette lineære arrangement af sp hybrid orbitaler giver mulighed for optimal overlapning med 1s orbitaler af de to hydrogenatomer.
Overlapningen af sp-hybridorbitaler af beryllium med 1s-orbitaler af hydrogen resulterer i dannelsen af to Be-H-bindinger. Disse bindinger er kovalente i naturen, hvilket betyder, at de dannes ved deling af elektroner mellem beryllium- og brintatomerne.
Sammenfattende er hybridiseringen af Be i BeH2 sp, hvilket resulterer i dannelsen af to ækvivalente sp hybridorbitaler, der overlapper med 1s orbitaler af de to hydrogenatomer for at danne to Be-H bindinger.
 Varme artikler
Varme artikler
-
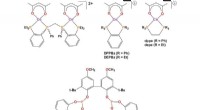 Nyt koboltkompleks kunne reducere omkostningerne ved hydroformyleringStrukturer af cobaltkatalysator-forstadier og biphenphos-ligand i denne undersøgelse. Kredit: Videnskab (2020). DOI:10.1126/science.aaw7742 Et team af forskere fra Louisiana State University og E
Nyt koboltkompleks kunne reducere omkostningerne ved hydroformyleringStrukturer af cobaltkatalysator-forstadier og biphenphos-ligand i denne undersøgelse. Kredit: Videnskab (2020). DOI:10.1126/science.aaw7742 Et team af forskere fra Louisiana State University og E -
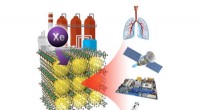 Sammenføjning af xenongas ud af affaldsstrømmeMetal organiske rammer, med nanoporer og høj affinitet for xenon, kan adskille gassen fra luft eller affaldsstrømme. Xenon har applikationer inden for forskellige områder, herunder belysning, rumfremd
Sammenføjning af xenongas ud af affaldsstrømmeMetal organiske rammer, med nanoporer og høj affinitet for xenon, kan adskille gassen fra luft eller affaldsstrømme. Xenon har applikationer inden for forskellige områder, herunder belysning, rumfremd -
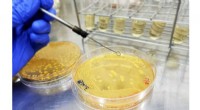 Konstrueret mikrobiel produktion af druesmagBillede 1: Konstruerede bakterier, der producerer druesmag. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Forskere rapporterer om en mikrobiel metode til fremstilling af en ku
Konstrueret mikrobiel produktion af druesmagBillede 1: Konstruerede bakterier, der producerer druesmag. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Forskere rapporterer om en mikrobiel metode til fremstilling af en ku -
 Frysetørrede jordbær og is giver et meget stabilt forholdKredit:CC0 Public Domain ARS-forskere har vist, at nogle frysetørrede bærpulvere - især frysetørret jordbærpulver - kan fungere som fremragende stabilisatorer i is og andre frosne mejerideesserter
Frysetørrede jordbær og is giver et meget stabilt forholdKredit:CC0 Public Domain ARS-forskere har vist, at nogle frysetørrede bærpulvere - især frysetørret jordbærpulver - kan fungere som fremragende stabilisatorer i is og andre frosne mejerideesserter
- Heftige løbeild stoppede i det sydlige Frankrig
- Instrument øger analyse af små, ekstremt mørke materialer
- En klingende raket tager endnu et kig på Solen
- Fysikere bekæmper laserkaos med kvantekaos for at forbedre laserydelsen
- Krydstogtsskibe genstarter i Venedig, bringe miljøprotester
- Planeter omkring et sort hul? Beregninger viser muligheden for bizarre verdener


