Hvad sker der med de partikler, der udgør en isterning, når de smeltes?
1. Faseovergang :Processen med smeltning involverer en faseovergang fra en fast til en flydende tilstand. Når varmeenergi tilføres isterningen, svækkes de intermolekylære kræfter, der holder vandmolekylerne i en fast krystallinsk struktur. Denne nedbrydning af krystalgitteret gør det muligt for vandmolekylerne at bevæge sig mere frit.
2. Øget kinetisk energi :Når isterningen absorberer varme, øges dens partiklers kinetiske energi. Det betyder, at vandmolekylerne bevæger sig hurtigere og med større energi. Stigningen i kinetisk energi overvinder de tiltrækkende kræfter mellem molekylerne, hvilket giver dem mulighed for at bryde fri fra isens stive struktur.
3. Øget intermolekylær afstand :Efterhånden som vandmolekylerne får energi og bevæger sig hurtigere, øges den gennemsnitlige afstand mellem dem. Denne udvidelse i den gennemsnitlige afstand mellem molekyler er det, der får isterningen til at udvide sig og til sidst smelte.
4. Danning af flydende vand :I takt med at isterningen fortsætter med at absorbere varme, bryder flere og flere vandmolekyler væk fra den krystallinske struktur. Til sidst får alle molekylerne nok energi til at overvinde de intermolekylære kræfter og bliver fuldstændig uordnede. På dette tidspunkt er isterningen helt smeltet, og vandmolekylerne er i flydende tilstand.
5. Densitetsændring :Tætheden af is er lavere sammenlignet med flydende vand. Dette skyldes, at den stive krystalstruktur i is efterlader mere tomrum mellem molekylerne. Når isen smelter, bliver molekylerne tættere pakket, hvilket resulterer i en stigning i tætheden. Denne tæthedsforskel er grunden til, at is flyder på vandet.
Husk, at disse ændringer primært tilskrives tilførsel af varmeenergi. Ved at tilføre varme til isterningen får molekylerne nok energi til at bryde fri fra den ordnede struktur af den faste tilstand og gå over i den mere uordnede flydende tilstand.
Sidste artikelHvad sker der, når en væske afkøles til dets frysepunkt?
Næste artikelKan gasser og væsker transportere varme ved ledning?
 Varme artikler
Varme artikler
-
 Rensning af luften:En reduktionsbaseret løsning på nitrogenforurening med en ny katalysatorEn ny jernkatalysator hjælper fortrinsvis med at reducere nitrogenoxid til hydroxylamin, åbne døre til forureningskontrol og ren energi. Kredit:Gwangju Institute of Science and Technology (GIST) V
Rensning af luften:En reduktionsbaseret løsning på nitrogenforurening med en ny katalysatorEn ny jernkatalysator hjælper fortrinsvis med at reducere nitrogenoxid til hydroxylamin, åbne døre til forureningskontrol og ren energi. Kredit:Gwangju Institute of Science and Technology (GIST) V -
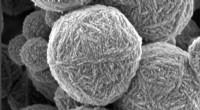 kolloide geler, allestedsnærværende i hverdagsprodukter, røbe deres hemmelighederDisse partikler, der ligner mikroskopiske kugler af strikkeuld, er faktisk uorganiske zeolitpartikler. De mikroporøse krystallinske partikler dannes via udfældning, efterhånden som de kolloide alumino
kolloide geler, allestedsnærværende i hverdagsprodukter, røbe deres hemmelighederDisse partikler, der ligner mikroskopiske kugler af strikkeuld, er faktisk uorganiske zeolitpartikler. De mikroporøse krystallinske partikler dannes via udfældning, efterhånden som de kolloide alumino -
 Smart løsning til at opdage fordærvelse af skaldyrKredit:CC0 Public Domain Vigtigt, Flinders Universitys professor i akvakultur Jian Qin - der ledede undersøgelsen sammen med Flinders kollega professor Youhong Tang - siger, at denne enkle enhed k
Smart løsning til at opdage fordærvelse af skaldyrKredit:CC0 Public Domain Vigtigt, Flinders Universitys professor i akvakultur Jian Qin - der ledede undersøgelsen sammen med Flinders kollega professor Youhong Tang - siger, at denne enkle enhed k -
 Udstødningsgassen fra et kraftværk kan genvindes og bruges som et reaktionsråmaterialeFig. 1 Oversigt over processen ved hjælp af H2 -stripping -regenereringsteknologi CO2 -partialtryk i desorberen sænkes af H2 tilført til bunden af desorberen og masseoverførslen af CO2 fra en flyd
Udstødningsgassen fra et kraftværk kan genvindes og bruges som et reaktionsråmaterialeFig. 1 Oversigt over processen ved hjælp af H2 -stripping -regenereringsteknologi CO2 -partialtryk i desorberen sænkes af H2 tilført til bunden af desorberen og masseoverførslen af CO2 fra en flyd
- Måling af miljøpåvirkningen af en vandkraftdæmning ved Inukjuak
- Banebrydende enzymforskning kæmper tilbage mod plastikforurening
- Kystændringer forværrer generende oversvømmelser på mange amerikanske kyster, undersøgelse find…
- Selvorganisering af komplekse strukturer
- Forskere opdager, hvordan chlamydiae formerer sig i menneskelige celler
- Sådan finder du et referencenummer


