Hvad sker der, hvis du blander et kemikalie med brintoverilte?
1. Kaliumiodid (KI) :Blanding af hydrogenperoxid med kaliumiodid resulterer i frigivelse af jodgas. Denne reaktion er almindeligvis brugt i kemi demonstrationer og kan observeres som en brunfarvet gas, der dannes.
2. Mangandioxid (MnO2) :Hydrogenperoxid reagerer med mangandioxid og danner iltgas. Denne reaktion bruges ofte i videnskabsmesseeksperimenter til at generere ilt. Iltgassen kan opsamles og testes med en glødende skinne.
3. Natriumbicarbonat (NaHCO3) :Når hydrogenperoxid tilsættes natriumbicarbonat, gennemgår det en nedbrydningsreaktion, hvorved der frigives kuldioxidgas. Denne reaktion bruges almindeligvis til at skabe brusende effekter i videnskabsprojekter eller natronvulkaner.
4. Gær :Hydrogenperoxid kan bruges til at dræbe gærceller. Når brintoverilte kommer i kontakt med gær, beskadiger det cellemembranerne og får cellerne til at dø. Denne egenskab bruges nogle gange til at desinficere overflader eller rense bryggeudstyr.
5. Brændbare materialer :Hydrogenperoxid er et stærkt oxidationsmiddel og kan reagere kraftigt med brændbare materialer, såsom papir, træ eller benzin. Disse reaktioner kan producere flammer eller endda eksplosioner, især i lukkede rum.
6. Syrer :Hydrogenperoxid reagerer med syrer og danner vand og ilt. Reaktionen er normalt ledsaget af frigivelse af varme og brus.
Det er vigtigt at bemærke, at blanding af kemikalier kan være farligt, og reaktionerne er måske ikke altid forudsigelige. Håndter altid kemikalier med forsigtighed, følg korrekte sikkerhedsprotokoller og konsulter sikkerhedsdatablade (SDS), før du blander forskellige stoffer.
 Varme artikler
Varme artikler
-
 Ingeniører tester medicinoverførsel ved hjælp af placenta-på-en-chipHuh-laboratoriets placenta-på-en-chip har to mikrofluidiske kanaler, der repræsenterer moderens og føtale kredsløbssystemer, og en membran med levende celler fra placentabarrieren, der adskiller de to
Ingeniører tester medicinoverførsel ved hjælp af placenta-på-en-chipHuh-laboratoriets placenta-på-en-chip har to mikrofluidiske kanaler, der repræsenterer moderens og føtale kredsløbssystemer, og en membran med levende celler fra placentabarrieren, der adskiller de to -
 Redesigner håndsprit og donerer 7, 000 gallons til at bekæmpe COVID-19Håndsprit reddet af ethanol. Et velgørende initiativ kørte for at forhindre håndsprit i at løbe kritisk lavt over hele landet. Kredit:Georgia Tech/Christopher Moore Så mange mennesker, Seth Marder
Redesigner håndsprit og donerer 7, 000 gallons til at bekæmpe COVID-19Håndsprit reddet af ethanol. Et velgørende initiativ kørte for at forhindre håndsprit i at løbe kritisk lavt over hele landet. Kredit:Georgia Tech/Christopher Moore Så mange mennesker, Seth Marder -
 Forskere udvikler en kraftfuld familie af 2D-materialerKredit:CC0 Public Domain Et hold fra Tulane University School of Science and Engineering har udviklet en ny familie af todimensionelle materialer, som forskere siger har lovende anvendelser, herund
Forskere udvikler en kraftfuld familie af 2D-materialerKredit:CC0 Public Domain Et hold fra Tulane University School of Science and Engineering har udviklet en ny familie af todimensionelle materialer, som forskere siger har lovende anvendelser, herund -
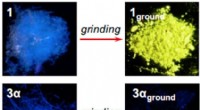 Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes9-anthryl guld(I) isocyanid (3α) bliver usynligt og udsender infrarødt efter det er malet, mens phenylguld(I) isocyanid (1) bliver gult. Kredit:Seki T. et al., Journal of the American Chemical Societ
Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes9-anthryl guld(I) isocyanid (3α) bliver usynligt og udsender infrarødt efter det er malet, mens phenylguld(I) isocyanid (1) bliver gult. Kredit:Seki T. et al., Journal of the American Chemical Societ
- Fashion Science Fair Project Idéer
- Tibetansk plateau steg senere, end vi troede
- En vindtunnel designet til at simulere Mars' støvede overflade
- Forskere fanger høj kontrastbillede af bånd af DNA -fiber
- Hvem er ansvarlig, når en indsat begår selvmord?
- Miljøforkæmpere tager Norge for retten i forbindelse med boringer i Arktis


