Hvorfor er nitrogens kogepunkt mindre end oxygen, selvom det danner flere kovalente bindinger?
Antallet af kovalente bindinger i et molekyle påvirker ikke direkte dets kogepunkt. Kogepunktet bestemmes af styrken af de intermolekylære kræfter mellem molekyler, ikke styrken af de kovalente bindinger i molekyler.
 Varme artikler
Varme artikler
-
 Forskere udvikler et pengeskab, billig teknologi til desinfektion af emballerede ægOmkostningerne ved bestråling af plastemballage (10 æg) vil ikke overstige 1,2 eurocent. Kredit:UrFU / Ilya Safarov Russiske forskere har udviklet en billig, sikker, og pålidelig overflade desinfe
Forskere udvikler et pengeskab, billig teknologi til desinfektion af emballerede ægOmkostningerne ved bestråling af plastemballage (10 æg) vil ikke overstige 1,2 eurocent. Kredit:UrFU / Ilya Safarov Russiske forskere har udviklet en billig, sikker, og pålidelig overflade desinfe -
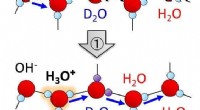 Unikke strukturelle udsving ved isoverfladen fremmer autoionisering af vandmolekylerSkematisk illustration af H/D isotopudvekslingsproces af vandmolekyler induceret af autoionisering og efterfølgende protonoverførsel. Kredit:NINS/IMS Vandis er et af de mest forekommende faste sto
Unikke strukturelle udsving ved isoverfladen fremmer autoionisering af vandmolekylerSkematisk illustration af H/D isotopudvekslingsproces af vandmolekyler induceret af autoionisering og efterfølgende protonoverførsel. Kredit:NINS/IMS Vandis er et af de mest forekommende faste sto -
 Udstiller moderne falsknereRobert Trotter smedede Sarah Honns billede af 1866 først i anden halvdel af det 20. århundrede. Kredit:James Hamm, Buffalo State College, State University of New York, Bøffel, NY Kunstmarkedet boo
Udstiller moderne falsknereRobert Trotter smedede Sarah Honns billede af 1866 først i anden halvdel af det 20. århundrede. Kredit:James Hamm, Buffalo State College, State University of New York, Bøffel, NY Kunstmarkedet boo -
 Kunstig receptor skelner mellem mandlige og kvindelige hormonerEn skematisk fremstilling af den selektive binding af testosteron fra en blanding af testosteron, progesteron, og beta-østradiol i vand. Receptoren har et indre hulrum med en diameter på cirka en nano
Kunstig receptor skelner mellem mandlige og kvindelige hormonerEn skematisk fremstilling af den selektive binding af testosteron fra en blanding af testosteron, progesteron, og beta-østradiol i vand. Receptoren har et indre hulrum med en diameter på cirka en nano
- Hvordan man bruger sammenfiltring til langdistance- eller frirumkvantekommunikation
- Ydmyge ledere øger medarbejdernes arbejdspladsstatus og lederpotentiale, finder undersøgelse
- NASA fanger orkanen Juliette over Mexicos Socorro Island
- Ny undersøgelse opdager ældgammelt meteoritisk nedslag over Antarktis 430, 000 år siden
- Hvilken type pladegrænse opstår mellem Nazca og Sydamerikansk plade?
- Billede:Beringstrædet


