Hvordan kunne du adskille sølvchlorid fra bariumchlorid?
Når AgCl tilsættes til vandig ammoniak, reagerer det og danner en opløselig kompleksion, [Ag(NH3)2]Cl. Denne komplekse ion kan derefter adskilles fra den uopløselige BaCl2 ved filtrering. Filtratet kan derefter inddampes til tørhed for at opnå ren AgCl.
Den samlede reaktion for opløsning af AgCl i vandig ammoniak er:
$$\text{AgCl (s)} + 2\text{NH}_3 (\text{aq}) \rightarrow [\text{Ag}(\text{NH}_3)_2]^+ (\text{aq} }) + \text{Cl}^- (\text{aq})$$
Denne reaktion er reversibel, og ligevægtskonstanten for reaktionen er:
$$K =\frac{[\text{Ag}(\text{NH}_3)_2]^+[\text{Cl}^-]}{[\text{AgCl}]}$$
Værdien af K er meget stor, hvilket betyder, at reaktionen forløber næsten helt til højre, hvilket resulterer i dannelsen af den opløselige kompleksion [Ag(NH3)2]Cl.
 Varme artikler
Varme artikler
-
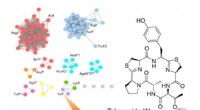 Genomminedrift fører til en ny type peptidprenyleringFigur 1:Målrettet genom -minedrift af prenyltransferaser identificerede TolF -enzymet og tol biosyntetisk genklynge (BGC). Øverst til venstre viser et proteinsekvens -lighednetværk af prenyltransfer
Genomminedrift fører til en ny type peptidprenyleringFigur 1:Målrettet genom -minedrift af prenyltransferaser identificerede TolF -enzymet og tol biosyntetisk genklynge (BGC). Øverst til venstre viser et proteinsekvens -lighednetværk af prenyltransfer -
 Syntese af opiumalkaloider ved hjælp af elektrisk strømDe Mainz-baserede kemikere undersøgte det oxidative nøgletrin i biosyntesen af thebain, kodein, og morfin ved hjælp af en simpel og selvfremstillet elektrokemisk celle. Kredit:Alexander Lipp For
Syntese af opiumalkaloider ved hjælp af elektrisk strømDe Mainz-baserede kemikere undersøgte det oxidative nøgletrin i biosyntesen af thebain, kodein, og morfin ved hjælp af en simpel og selvfremstillet elektrokemisk celle. Kredit:Alexander Lipp For -
 Saltning af omkostningerne ved proteinpolymerlægemidlerKredit:Carnegie Mellon University, Institut for Kemiteknik Protein er en stor forretning. Ikke alene udgør den en betydelig del af alle levende ting-det er også en industri på 150 milliarder dolla
Saltning af omkostningerne ved proteinpolymerlægemidlerKredit:Carnegie Mellon University, Institut for Kemiteknik Protein er en stor forretning. Ikke alene udgør den en betydelig del af alle levende ting-det er også en industri på 150 milliarder dolla -
 Atomisk tynde perovskites booster til fremtidig elektronikKredit:National Institute for Materials Science WPI-MANA har udviklet verdens højeste ydeevne dielektriske nanofilm ved hjælp af atomisk tynde perovskiter. Denne teknologi kan revolutionere næst
Atomisk tynde perovskites booster til fremtidig elektronikKredit:National Institute for Materials Science WPI-MANA har udviklet verdens højeste ydeevne dielektriske nanofilm ved hjælp af atomisk tynde perovskiter. Denne teknologi kan revolutionere næst
- Brug af kulstof nanorør i lithium-batterier kan dramatisk forbedre energikapaciteten
- Ytringsfrihedskrigernes mærkelige oprindelse
- Lunar Gateway vil bevare sin bane med en 6 kW ionmotor
- Gør byer mere gåbare ved at forstå, hvordan andre mennesker påvirker vores rejser
- Hvor meget ilt skal der til for at opretholde forbrændingen?
- Hvorfor absorberer epiblema og rodhår ioner ved at bruge energi?


