Hvor mange gram ammoniumsulfat skal der til for at lave en 0,25 M opløsning ved en koncentration på 6M?
Masse =Molaritet x Volumen x Molekylvægt
Givet:
Molaritet (M) =0,25 M
Volumen (V) =1 L (forudsat at vi vil lave 1 liter af opløsningen)
Molekylvægt af ammoniumsulfat ((NH4)2SO4) =132,14 g/mol
1. Beregn antallet af nødvendige mol ammoniumsulfat:
Moles =Molaritet x Volumen
Mol =0,25 mol/L x 1 L =0,25 mol
2. Beregn massen af ammoniumsulfat:
Masse =mol x molekylvægt
Masse =0,25 mol x 132,14 g/mol =33,04 g
Derfor skal der 33,04 gram ammoniumsulfat til for at lave en 0,25 M opløsning i en koncentration på 6M.
 Varme artikler
Varme artikler
-
 To-trins gassensor rapporterer om jordens dynamikEn robust to-trins mikrobiel sensor udviklet ved Rice University vil hjælpe forskere med at observere genekspression og biotilgængelighed af næringsstoffer i miljøer som jord og sedimenter uden at for
To-trins gassensor rapporterer om jordens dynamikEn robust to-trins mikrobiel sensor udviklet ved Rice University vil hjælpe forskere med at observere genekspression og biotilgængelighed af næringsstoffer i miljøer som jord og sedimenter uden at for -
 Video:Sådan virker dobbeltvirkende bagepulver to gangeKredit:The American Chemical Society Bagepulver bruges til at hæve bagværk som kager og småkager. Det sælges ofte under mærket dobbeltvirkende, men hvad betyder det? I denne video, Reaktioner for
Video:Sådan virker dobbeltvirkende bagepulver to gangeKredit:The American Chemical Society Bagepulver bruges til at hæve bagværk som kager og småkager. Det sælges ofte under mærket dobbeltvirkende, men hvad betyder det? I denne video, Reaktioner for -
 Ny metode beregner ligevægtskonstanten i lille skalaBlanding af beregningskemi og teoretisk matematik viste sig at være en vindende formel for Emory-kemikeren James Kindt (i midten), hans kandidatstuderende (fra venstre) Xiaokun Zhang og Lara Patel, og
Ny metode beregner ligevægtskonstanten i lille skalaBlanding af beregningskemi og teoretisk matematik viste sig at være en vindende formel for Emory-kemikeren James Kindt (i midten), hans kandidatstuderende (fra venstre) Xiaokun Zhang og Lara Patel, og -
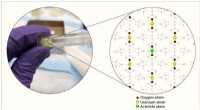 Undersøgelse afslører et-trins strategi for genanvendelse af brugt nukleart brændselEt-trins kemisk reaktion foreskrevet i undersøgelsen fører til dannelsen af krystaller, der indeholder uran (gulfyldte cirkler) og små mængder af andre resterende brændstofelementer (grønfyldte cirk
Undersøgelse afslører et-trins strategi for genanvendelse af brugt nukleart brændselEt-trins kemisk reaktion foreskrevet i undersøgelsen fører til dannelsen af krystaller, der indeholder uran (gulfyldte cirkler) og små mængder af andre resterende brændstofelementer (grønfyldte cirk
- Har Scott Pruitt en solid begrundelse for at ophæve Clean Water Rule?
- Flere børn gentager en karakter. Er det godt for dem?
- Fangst begyndelsen af galakse-rotation i det tidlige univers
- GPS hjælper med at give mere præcise nedbørsprognoser
- Temperaturerne i det ydre rum omkring Jorden
- Forskningsfremskridt i den videnskabelige undersøgelse af Yarlung Tsangbo Grand Canyon


