Finder du de normale fryse- og kogepunkter for 21,2 g NaCl i 135 ml vand?
$\Delta T_f=K_f m$
$\Delta T_b=K_b m$
hvor $\Delta T_f$ er frysepunktsnedsættelsen, $\Delta T_b$ er kogepunktshøjden, $K_f$ er frysepunktsnedsættelseskonstanten for opløsningsmidlet ($1,86^\circ C/m$ for vand), $K_b $ er kogepunktets højdekonstanten for opløsningsmidlet ($0,512^\cirkel C/m$ for vand) og $m$ er opløsningens molalitet.
For at beregne frysepunktsnedsættelsen og kogepunktsforhøjelsen af en 21,2 g NaCl i 135 ml vandopløsning, skal vi først beregne molaliteten af opløsningen.
$m=\frac {mol \ af \ NaCl}{kg \ af \ vand}$
Først skal vi konvertere gram NaCl til mol:
$M NaCl =\frac{ 21,2 \ g}{58,44 g/mol} =0,363 mol$
Massen i kg af opløsningsmidlet (vand) er:
$$135 \ g \ H_2 O \time \frac{1 Kg}{1000 \ g} =0,135 Kg$$
Derfor er molaliteten:
$$m=\frac{0,363 \ mol}{0,135 \ Kg}=2,69 $$
Nu kan vi beregne frysepunktsnedsættelsen og kogepunktshøjden:
$\Delta T_f=K_f m =(1,86 ^\circ C/m) (2,69 m) =5,006^\circ C$
$\Delta T_b=K_b m =(0,512 ^\circ C/m) (2,69 m) =1,38^\circ C$
Til sidst beregner vi de nye fryse- og kogepunkter:
Frysepunkt:$0^\circ C - 5,006^\circ C$ \(=-5,006 ^oC \)
Kogepunkt:$100^\circ C + 1,38^\circ C$ \(=101,38 ^oC \)
 Varme artikler
Varme artikler
-
 2 forskere vinder Nobels kemipris for genredigeringsværktøjI denne 14. marts, 2016 filfoto Amerikansk biokemiker Jennifer A. Doudna, venstre, og den franske mikrobiolog Emmanuelle Charpentier, ret, udgør et foto i Frankfurt, Tyskland. Den franske videnskabsma
2 forskere vinder Nobels kemipris for genredigeringsværktøjI denne 14. marts, 2016 filfoto Amerikansk biokemiker Jennifer A. Doudna, venstre, og den franske mikrobiolog Emmanuelle Charpentier, ret, udgør et foto i Frankfurt, Tyskland. Den franske videnskabsma -
 Forskere vil undersøge fremtidig brug af bakteriebaserede aktive midlerDr. Pattanathu Rahman. Kredit:University of Portsmouth Biosurfaktanter med evnen til at erstatte skadelige petroleumsbaserede overfladeaktive stoffer i dagligvarer er et skridt tættere på at blive
Forskere vil undersøge fremtidig brug af bakteriebaserede aktive midlerDr. Pattanathu Rahman. Kredit:University of Portsmouth Biosurfaktanter med evnen til at erstatte skadelige petroleumsbaserede overfladeaktive stoffer i dagligvarer er et skridt tættere på at blive -
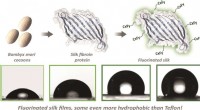 Forskere bruger modificerede silkeproteiner til at skabe nye nonstick-overfladerGrafisk abstrakt. Kredit:ChemBioChem (2022). DOI:10.1002/cbic.202200429 Forskere ved Tufts University har udviklet en metode til at lave silkebaserede materialer, der nægter at holde sig til vand,
Forskere bruger modificerede silkeproteiner til at skabe nye nonstick-overfladerGrafisk abstrakt. Kredit:ChemBioChem (2022). DOI:10.1002/cbic.202200429 Forskere ved Tufts University har udviklet en metode til at lave silkebaserede materialer, der nægter at holde sig til vand, -
 Udvidelse af biosyntesevejen via retrobiosynteseBiosyntetiske reaktioner konstrueret i E. coli til in vivo produktion af 12 SCPAer. Disse 12 SCPAer var dem, der viste sig at blive produceret af valin decarboxylase (VlmD) in vitro (stiplede kasser).
Udvidelse af biosyntesevejen via retrobiosynteseBiosyntetiske reaktioner konstrueret i E. coli til in vivo produktion af 12 SCPAer. Disse 12 SCPAer var dem, der viste sig at blive produceret af valin decarboxylase (VlmD) in vitro (stiplede kasser).
- NASA ser Tropical Storm Man-yi nærme sig tyfonstyrke Tropical Storm Man-Yi con
- Aerosoler tilføjer en ny rynke til klimaændringer i det tropiske Stillehav
- Et tip for langt? Hvorfor træthed kan sætte ind for nordamerikanere
- Nanoteknologi afslører skjulte dybder i bakterielle maskiner
- Højdepunkt:Kvasi-krystallinsk orden på nanoskala
- Den kriseramte Nissan ryster om bord, holder chef


