Hvad beskriver bedst en nedbrydningsreaktion?
Her er en sammenbrud:
* en reaktant: Reaktionen starter med et enkelt stof (reaktanten).
* Flere produkter: Reaktanten opdeles i to eller flere forskellige stoffer (produkterne).
* Energiindgang: Nedbrydningsreaktioner kræver normalt energiindgang for at bryde bindingerne i reaktantmolekylet. Denne energi kan være i form af varme, lys eller elektricitet.
Eksempler:
* Elektrolyse af vand: Vand (H₂O) nedbrydes til brintgas (H₂) og iltgas (O₂) ved at føre en elektrisk strøm gennem den.
* Opvarmning af calciumcarbonat: Calciumcarbonat (Caco₃) nedbrydes i calciumoxid (CAO) og kuldioxidgas (CO₂), når den opvarmes.
Nøglepunkter:
* Nedbrydningsreaktioner er det modsatte af synteseaktioner, hvor to eller flere stoffer kombineres for at danne en enkelt forbindelse.
* Disse reaktioner er almindelige i mange kemiske processer, herunder nedbrydning af mad i vores kroppe og produktion af metaller fra malm.
 Varme artikler
Varme artikler
-
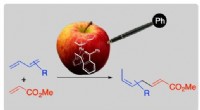 Phenyltilsætning gjorde en gift nyttig til en kemisk reaktion i katalyseTag for eksempel et forgiftet æble, det kan udsende en berusende blød aroma bare ved at stikke en kuglepen og skifte til at være lækker. Kreditering:Figur tilpasset med tilladelse fra Organometallics,
Phenyltilsætning gjorde en gift nyttig til en kemisk reaktion i katalyseTag for eksempel et forgiftet æble, det kan udsende en berusende blød aroma bare ved at stikke en kuglepen og skifte til at være lækker. Kreditering:Figur tilpasset med tilladelse fra Organometallics, -
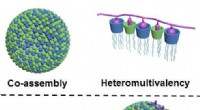 Kemikere udvikler ny metode til selektiv binding af proteinerFigur øverst:Gennem sammontering, to komponenter af lipidtypen danner nano-partikler i vand, som har et meget stort antal forskellige kontaktpunkter (vist med blå og grøn; til venstre). Som et resulta
Kemikere udvikler ny metode til selektiv binding af proteinerFigur øverst:Gennem sammontering, to komponenter af lipidtypen danner nano-partikler i vand, som har et meget stort antal forskellige kontaktpunkter (vist med blå og grøn; til venstre). Som et resulta -
 Squishy hydras simple kredsløb klar til deres nærbilledeEn hydra trækkes ind i en pipette som forberedelse til indsættelse i et mikrofluidisk kammer. Kredit:Jeff Fitlow Bare fordi et dyr er blødt og squishy, betyder det ikke, at det ikke er hårdt. Ek
Squishy hydras simple kredsløb klar til deres nærbilledeEn hydra trækkes ind i en pipette som forberedelse til indsættelse i et mikrofluidisk kammer. Kredit:Jeff Fitlow Bare fordi et dyr er blødt og squishy, betyder det ikke, at det ikke er hårdt. Ek -
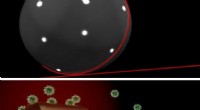 At sætte fokus på livets maskineriEn sensor på en sensor:Laserlys (rødt) skinner (øverst) ind i en mikroperle af glas, som en guld nanorod er fastgjort til. Laserlyset løber rundt om indersiden af mikroperlen og er koncentreret om g
At sætte fokus på livets maskineriEn sensor på en sensor:Laserlys (rødt) skinner (øverst) ind i en mikroperle af glas, som en guld nanorod er fastgjort til. Laserlyset løber rundt om indersiden af mikroperlen og er koncentreret om g
- Hvordan bruges magnetisme i mobiltelefoner?
- Hvad er de 4 organiske makro -mol?
- Hvad er tre ting, som wegener brugte til at udvikle sin teori om kontinentaldrift?
- Sunde menumuligheder i håndskrevne skrifttyper giver positiv respons
- Ny ramme giver nøjagtighed, effektivitet til at identificere stopord
- Sådan beregnes kubevægt


