Hvordan påvirker en stigning i temperaturen en gas evne til at gå i opløsning?
* opløselighed og temperatur: Opløseligheden af en gas i en væske er direkte relateret til det delvise tryk på gassen over væsken. Temperatur spiller imidlertid en betydelig rolle i dette forhold.
* kinetisk energi: Når du øger temperaturen, øger du gasmolekylernes kinetiske energi. Disse molekyler bevæger sig hurtigere og har mere energi, hvilket gør det lettere for dem at undslippe den flydende fase og vende tilbage til den gasformige fase.
* ligevægtsskift: Opløsningen af en gas i en væske er en ligevægtsproces. Forøgelse af temperaturen skifter ligevægten mod den gasformige tilstand, hvilket reducerer mængden af gas, der er opløst i væsken.
Tænk på det på denne måde: Forestil dig en gas fanget i en væske. Når temperaturen stiger, bliver gasmolekylerne ophidset og "hopp" omkring mere kraftigt. De er mere tilbøjelige til at bryde fri fra de attraktive kræfter, der holder dem i væsken og flygter i luften ovenfor.
Eksempler:
* kulsyreholdige drikkevarer: Når du åbner en dåse eller flaske soda, slipper gas (CO2), fordi trykket frigøres, og temperaturen på drikken øges.
* kogende vand: Når vand koger, frigøres de opløste gasser som ilt og nitrogen, hvilket fører til dannelse af bobler.
Undtagelser:
Mens den generelle regel er, at stigende temperatur mindsker gasopløseligheden, er der nogle få undtagelser. Nogle gasser, som ammoniak (NH3), bliver faktisk mere opløselige i vand ved højere temperaturer. Disse undtagelser skyldes ofte komplekse kemiske interaktioner mellem gassen og opløsningsmidlet.
Kortfattet: Forøgelse af temperaturen gør det generelt sværere for gasser at opløses i væsker, da den øgede kinetiske energi i gasmolekylerne fremmer deres flugt fra opløsningen.
 Varme artikler
Varme artikler
-
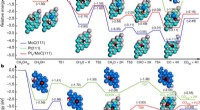 Brug af platin-molybdæncarbid til katalytisk at frigive brint til at drive en brændselscelleReaktionsvej for brintproduktion fra methanol og vand. Kredit:(c) Natur (2017). DOI:10.1038/nature21672 (Phys.org) - Et team af forskere fra flere institutioner i Kina og USA har udviklet en måd
Brug af platin-molybdæncarbid til katalytisk at frigive brint til at drive en brændselscelleReaktionsvej for brintproduktion fra methanol og vand. Kredit:(c) Natur (2017). DOI:10.1038/nature21672 (Phys.org) - Et team af forskere fra flere institutioner i Kina og USA har udviklet en måd -
 Model til 2-D materialebaseret RRAM fundetResistiv random access -hukommelse lavet af grafenelektroder og hexagonalt bornitrid -dielektrikum. Kredit:Copyright American Institute of Physics 2017. Gengivet med tilladelse fra forfatterne. Gr
Model til 2-D materialebaseret RRAM fundetResistiv random access -hukommelse lavet af grafenelektroder og hexagonalt bornitrid -dielektrikum. Kredit:Copyright American Institute of Physics 2017. Gengivet med tilladelse fra forfatterne. Gr -
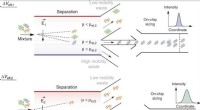 Mikrofluidik:2-D fingeraftryk af heterogene proteiner i opløsningOn-chip separation og analyse af blandinger i væskefase. Ved at justere den effektive spænding, Δveff, molekyler med en specifik elektroforetisk mobilitet, μ = μel, og dermed et specifikt forhold mell
Mikrofluidik:2-D fingeraftryk af heterogene proteiner i opløsningOn-chip separation og analyse af blandinger i væskefase. Ved at justere den effektive spænding, Δveff, molekyler med en specifik elektroforetisk mobilitet, μ = μel, og dermed et specifikt forhold mell -
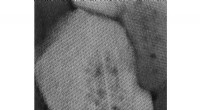 Materialeforskere går nærmere ind på sårbarheder involveret i menneskeligt tandfaldVerdens mindste sandwich. Et atomopløsnings scanningstransmissionselektronmikroskopibillede af en emalje krystallit, der kigger ned ad krystallens lange akse. De mørke områder viser magnesiumioner, de
Materialeforskere går nærmere ind på sårbarheder involveret i menneskeligt tandfaldVerdens mindste sandwich. Et atomopløsnings scanningstransmissionselektronmikroskopibillede af en emalje krystallit, der kigger ned ad krystallens lange akse. De mørke områder viser magnesiumioner, de
- Materiale, der holder ting koldt og varmt
- Hvad er opløsningsmidlet og opløstelsen i en indeholdende 100 g ethanol 3G saccharose?
- Hvor lang tid tog det at udruge et dinosauræg? Undersøgelsen siger 3-6 måneder
- Når atomer har lige mange protoner og elektroner, er de det?
- Hvilke dyr eller insekter spiser californiske sorteorme?
- Forbedring af katastroferespons gennem Twitter-data


