Hvilken har den største elektronegativitet xenon nitrogen eller lithium?
* Elektronegativitet er et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding.
* Tendenser inden for elektronegativitet:
* øges over en periode (fra venstre til højre): Atomer bliver mindre og har et stærkere greb på deres elektroner.
* falder ned i en gruppe (fra top til bund): Atomer bliver større, og deres valenselektroner er længere væk fra kernen, hvilket gør dem mindre tiltrukket.
Lad os se på elementernes positioner:
* Xenon (XE): Gruppe 18 (ædelgas), periode 5. Noble -gasser har meget lav elektronegativitet.
* nitrogen (n): Gruppe 15, periode 2.
* lithium (Li): Gruppe 1, periode 2.
Baseret på tendenser:
* Nitrogen vil have en højere elektronegativitet end lithium, fordi det er længere til højre i den periodiske tabel.
* Både nitrogen og lithium vil have højere elektronegativitet end Xenon, hvilket er en ædel gas.
Derfor har nitrogen (N) den største elektronegativitet ud af de tre elementer.
Sidste artikelHvilke elementer har den sammensatte PT3P4?
Næste artikelHvad er virkningen af isotonisk saltopløsning på RBC?
 Varme artikler
Varme artikler
-
 Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidlerKredit:Sisacom, Shutterstock Forskere har fundet en ny metode til at analysere, hvordan aktive midler påvirker et specifikt protein, der er vigtigt for celleoverlevelse. Deres forskning kan hjælpe
Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidlerKredit:Sisacom, Shutterstock Forskere har fundet en ny metode til at analysere, hvordan aktive midler påvirker et specifikt protein, der er vigtigt for celleoverlevelse. Deres forskning kan hjælpe -
 Forskere observerer skiftet af Ras-protein i detaljerDaniel Mann, Klaus Gerwert og Carsten Kötting (fra venstre) implementerer en proces til afkodning, der letter beregningen af eksperimentelle data såsom infrarøde spektre og nukleare spinspektre inds
Forskere observerer skiftet af Ras-protein i detaljerDaniel Mann, Klaus Gerwert og Carsten Kötting (fra venstre) implementerer en proces til afkodning, der letter beregningen af eksperimentelle data såsom infrarøde spektre og nukleare spinspektre inds -
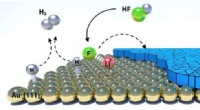 Batteriets skjulte lag afsløretReaktionsmekanismen til omdannelse af hydrogenfluorid (HF) urenhed fra elektrolytten til lithiumfluorid (LiF) i fast-elektrolytinterfasen (SEI) med frigivelse af hydrogengas (H2). SEI -laget er vist p
Batteriets skjulte lag afsløretReaktionsmekanismen til omdannelse af hydrogenfluorid (HF) urenhed fra elektrolytten til lithiumfluorid (LiF) i fast-elektrolytinterfasen (SEI) med frigivelse af hydrogengas (H2). SEI -laget er vist p -
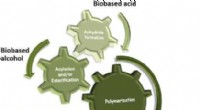 Økonomisk syntese af polyacrylater og polymethacrylater fra biobaserede materialerKredit:Angewandte Chemie På trods af industriens bedste indsats for at arbejde hen imod bæredygtighed, de fleste plastik (eller polymerer) er stadig fremstillet ved hjælp af ikke-fornybare fossile
Økonomisk syntese af polyacrylater og polymethacrylater fra biobaserede materialerKredit:Angewandte Chemie På trods af industriens bedste indsats for at arbejde hen imod bæredygtighed, de fleste plastik (eller polymerer) er stadig fremstillet ved hjælp af ikke-fornybare fossile
- Det er bydende nødvendigt at inkorporere naturlige processer for at udnytte økologiske kræfter og…
- NASA billeder viser anatomi af pakistan oversvømmelseskatastrofe
- Hundredvis marcherer i Berlin for at kræve, at man stopper brugen af kul
- Stjernestrøm af galaksen NGC 5907 har en anden morfologi end tidligere antaget
- Fordele ved kuludgang opvejer dets omkostninger
- Hvordan vil COVID-19 i sidste ende påvirke klimaændringerne?


