Hvordan opnås hydratiserede stoffer normalt?
1. Krystallisation fra opløsning:
* Dette er den mest almindelige metode. En løsning, der indeholder det ønskede stof, fremstilles og får derefter lov til at afkøle eller fordampe. Når opløsningsmidlet fordamper, eller temperaturen falder, falder stoffets opløselighed, hvilket fører til dannelse af krystaller.
* Eksempel: Hvis en opløsning af kobbersulfat får lov til at fordampe, dannes blå krystaller af kobbersulfatpentahydrat (cuso₄ · 5H₂O).
2. Reaktion i vandig opløsning:
* Nogle reaktioner i vandige opløsninger producerer direkte hydrerede forbindelser. Dette sker, når de reagerende arter har en stærk affinitet for vandmolekyler.
* Eksempel: Reaktionen af vandfri koboltchlorid (COCL₂) med vand resulterer i dannelsen af lyserød hydratiseret koboltchlorid (Cocl₂ · 6H₂O).
3. Direkte hydrering:
* Nogle vandfri forbindelser kan absorbere vand direkte fra atmosfæren. Denne proces er kendt som deliquescence .
* Eksempel: Vandfarvet calciumchlorid (CACL₂) er et stærkt tørremiddel (tørringsmiddel), fordi det let absorberer vand fra luften til dannelse af hydreret calciumchlorid (CaCl₂ · 2H₂O).
4. Kemiske reaktioner med vand:
* Nogle stoffer kan reagere kemisk med vand for at danne hydratiserede produkter.
* Eksempel: Når calciumoxid (CAO) reagerer med vand, danner det calciumhydroxid (Ca (OH) ₂), som ofte findes i den hydratiserede form (Ca (OH) ₂ · H₂O).
5. Hydrering af mineraler:
* Nogle mineraler findes naturligt i hydratiserede former. Disse hydratiserede former dannes normalt over geologiske tidsskalaer gennem interaktion med vand.
* Eksempel: Gips (caso₄ · 2H₂O) er et naturligt forekommende hydreret mineral.
Det er vigtigt at bemærke, at den specifikke metode, der bruges til at opnå et hydreret stof, afhænger af den specifikke forbindelse og dets egenskaber.
Sidste artikelHvad er store molekyler, der består af små kaldet?
Næste artikelHvordan skabes elementer fra helium til jern?
 Varme artikler
Varme artikler
-
 Team udvikler en ny metode til fremstilling af vedvarende acrylonitrilPå billedet fra venstre mod højre ses Adam Bratis, Violeta Sànchez i Nogué, Todd Eaton, Gregg Beckham, Vassili Vorotnikov, og Eric Karp, del af NREL-teamet, der arbejder på en konkurrencedygtig, bæred
Team udvikler en ny metode til fremstilling af vedvarende acrylonitrilPå billedet fra venstre mod højre ses Adam Bratis, Violeta Sànchez i Nogué, Todd Eaton, Gregg Beckham, Vassili Vorotnikov, og Eric Karp, del af NREL-teamet, der arbejder på en konkurrencedygtig, bæred -
 Forskere finder potentielt manglende led i kemi, der førte til liv på JordenKredit:CC0 Public Domain Kemikere ved The Scripps Research Institute (TSRI) har fundet en forbindelse, der kan have været en afgørende faktor i livets oprindelse på Jorden. Forskere fra livets op
Forskere finder potentielt manglende led i kemi, der førte til liv på JordenKredit:CC0 Public Domain Kemikere ved The Scripps Research Institute (TSRI) har fundet en forbindelse, der kan have været en afgørende faktor i livets oprindelse på Jorden. Forskere fra livets op -
 COVID-åndedrætstest-kan det være det næste? Forskning siger jaFra venstre:University of Canterbury forskere postdoktor Dr. Fiona Given og lektor Deborah Crittenden ved Biomolecular Interaction Center. Kredit:University of Canterbury Enhver, der har oplevet e
COVID-åndedrætstest-kan det være det næste? Forskning siger jaFra venstre:University of Canterbury forskere postdoktor Dr. Fiona Given og lektor Deborah Crittenden ved Biomolecular Interaction Center. Kredit:University of Canterbury Enhver, der har oplevet e -
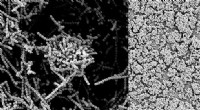 Sukker i modermælk er en ny klasse af antibakterielle midlerNærbilledet til venstre illustrerer, hvordan Strep-bakterier normalt klumper sig sammen for at danne en beskyttende biofilm. Billedet til højre viser, at biofilmen nedbrydes, når en Strep-kultur doser
Sukker i modermælk er en ny klasse af antibakterielle midlerNærbilledet til venstre illustrerer, hvordan Strep-bakterier normalt klumper sig sammen for at danne en beskyttende biofilm. Billedet til højre viser, at biofilmen nedbrydes, når en Strep-kultur doser
- Hvordan vandhjulsplanten snapper
- Individuel handling opnår ikke 1,5 C opvarmning – social forandring er nødvendig, som historien vi…
- Hvad blev middelalderlige kort lavet af?
- En lille defekt, der kan skabe mindre, Hurtigere elektronik
- Astronomi Spol hurtigt fremad for at genoplive zombie-astrofotos
- Forskellen mellem det menneskelige fordøjelsessystem og fordøjelsessystemet af en Cow


