Hvad er forskellen mellem syresalt og normalt salt?
Normale salte
* dannelse: Dannet ved fuldstændig neutralisering af en syre ved en base.
* sammensætning: Består af en metalkation (positiv ion) og en ikke-metalanion (negativ ion) fra syren.
* Eksempel: Natriumchlorid (NaCl), dannet fra den komplette neutralisering af saltsyre (HCI) ved natriumhydroxid (NaOH).
syresalte
* dannelse: Dannet af * delvis * neutralisering af en syre af en base.
* sammensætning: Indeholder udskiftelige hydrogenioner (H+) i deres formel. Disse hydrogenioner kan reagere med baser for at danne yderligere salte.
* Eksempel: Natriumbicarbonat (NAHCO3), dannet ved delvis neutralisering af kulsyre (H2CO3) af natriumhydroxid (NaOH). Bicarbonationen (HCO3-) har stadig en udskiftelig hydrogenion.
Nøgleforskelle
* Hydrogenioner: Syresalte har udskiftelige brintioner, mens normale salte ikke gør det.
* neutralisering: Normale salte er resultatet af komplet neutralisering, mens syresalte dannes ved delvis neutralisering.
* surhed: Syresalte er typisk sure eller svagt sure på grund af tilstedeværelsen af udskiftelige hydrogenioner. Normale salte kan være sure, basale eller neutrale afhængigt af den syre og base, der bruges til at danne dem.
Tænk på det sådan:
* Normalt salt: Du har blandet alle ingredienserne i din kage dej, og den er klar til at bage.
* Syresalt: Du har tilføjet nogle af ingredienserne, men der er stadig mere at blande sig i (de udskiftelige hydrogenioner).
Almindelige eksempler på syresalte
* Natriumbicarbonat (NAHCO3)
* Kaliumhydrogensulfat (KHSO4)
* Calciumhydrogenphosphat (CAHPO4)
Fortæl mig, hvis du gerne vil have yderligere forklaring eller eksempler!
Sidste artikelHvad opløses cyclohexanol bedst i?
Næste artikelHvor mange mol er til stede i 3,2 g Cuo?
 Varme artikler
Varme artikler
-
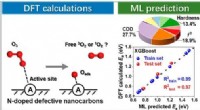 Reaktionsmekanisme for O3-aktivering og singlet-iltgenerering på N-dopet defekte nanocarbonerGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c08666 Et forskerhold ledet af prof. Cao Hongbin fra Institute of Process Engineering (IPE) ved det kinesiske
Reaktionsmekanisme for O3-aktivering og singlet-iltgenerering på N-dopet defekte nanocarbonerGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c08666 Et forskerhold ledet af prof. Cao Hongbin fra Institute of Process Engineering (IPE) ved det kinesiske -
 Polymerer i meteoritter giver spor til det tidlige solsystemTre lag hydrogenbundet kant-til-kant polymer. Hvert lag har fire polymerstænger bundet ved et centralt toppunkt. Atomer er farvet som følger:hydrogenhvid, carbon black, nitrogenblå, iltrød, silikone p
Polymerer i meteoritter giver spor til det tidlige solsystemTre lag hydrogenbundet kant-til-kant polymer. Hvert lag har fire polymerstænger bundet ved et centralt toppunkt. Atomer er farvet som følger:hydrogenhvid, carbon black, nitrogenblå, iltrød, silikone p -
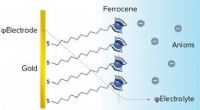 Kombineret tilgang til sondering af grænsefladeelektrokemi mere detaljeretFigur 1:Skematisk af et elektrokemisk aktivt ferrocen-termineret selvsamlet monolag på guld, som blev brugt som en model elektrokemisk grænseflade. Det elektrokemiske miljø illustreres af den potentie
Kombineret tilgang til sondering af grænsefladeelektrokemi mere detaljeretFigur 1:Skematisk af et elektrokemisk aktivt ferrocen-termineret selvsamlet monolag på guld, som blev brugt som en model elektrokemisk grænseflade. Det elektrokemiske miljø illustreres af den potentie -
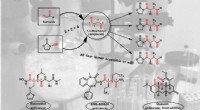 Når svovl forsvinder sporløstNy selektiv syntese af alle 1, 4-dicarbonylisomerer fra sulfoxider og udvalgte vigtige bioaktive forbindelser med 1, 4-dicarbonylmotiv. Kredit:© Maulide Group Mange naturprodukter og lægemidler ha
Når svovl forsvinder sporløstNy selektiv syntese af alle 1, 4-dicarbonylisomerer fra sulfoxider og udvalgte vigtige bioaktive forbindelser med 1, 4-dicarbonylmotiv. Kredit:© Maulide Group Mange naturprodukter og lægemidler ha
- Ny forskning afslører, hvordan elefanter 'ser' verden
- Har du fået at vide, at du er for følsom? Du er måske en empat
- Hvordan målretter Facebook-annoncer dig?
- At investere i ren energi giver økonomisk mening, siger eksperter
- Beregn de molekylære formler af forbindelser, der har følgende empriske og molære masser C2H5 58G…
- Uddybende spørgsmål:Hvordan lærer sangfugle at synge?


