Hvordan er temperaturen på en gas relateret til bevægelsesmolekyler?
* molekylær bevægelse: Gasmolekyler er konstant i tilfældig bevægelse og kolliderer med hinanden og væggene i deres beholder. Denne bevægelse kaldes kinetisk energi .
* Temperatur og kinetisk energi: Jo højere temperatur på en gas, jo hurtigere bevæger dens molekyler sig, og jo større er deres gennemsnitlige kinetiske energi. Omvendt betyder lavere temperaturer langsommere molekylær bevægelse og lavere gennemsnitlig kinetisk energi.
* Direkte proportionalitet: Forholdet mellem temperatur og kinetisk energi er direkte proportionalt. Dette betyder, at hvis du fordobler temperaturen på en gas, fordobler du den gennemsnitlige kinetiske energi for dens molekyler.
Her er en analogi: Forestil dig en gruppe mennesker, der danser. Hvis de alle bevæger sig langsomt og roligt, er "temperaturen" på dansegulvet lav. Hvis de begynder at danse vildt og energisk, øges "temperaturen" på dansegulvet.
Nøglepunkter:
* gennemsnitlig kinetisk energi: Temperaturen er et mål for den * gennemsnitlige * kinetiske energi af molekylerne, hvilket betyder, at der vil være en vis variation i hastighederne for individuelle molekyler.
* absolut temperatur: Den absolutte temperaturskala, målt i Kelvin (K), vedrører direkte kinetisk energi. Zero Kelvin (0 K) er absolut nul, hvor molekylær bevægelse teoretisk stopper.
* intern energi: Den samlede kinetiske energi for alle molekyler i en gas bidrager til dens indre energi.
Ansøgninger:
* gaslov: Forholdet mellem temperatur, tryk og volumen af en gas (ideel gaslov) er baseret på den kinetiske energi i dens molekyler.
* termodynamik: Undersøgelsen af varme og energioverførsel er meget afhængig af at forstå, hvordan temperaturen relaterer til molekylær bevægelse.
* Kemi: Kemiske reaktioner påvirkes ofte af temperatur, fordi det påvirker den hastighed, hvormed molekyler kolliderer og reagerer.
Fortæl mig, hvis du har yderligere spørgsmål!
Sidste artikelHvad er formen af et tetrachloridmolekyle kaldet?
Næste artikelHvordan kan en kemiske reaktioner, der bruges i vand?
 Varme artikler
Varme artikler
-
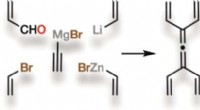 Anstrengt, symmetrisk, og nyt:Tetravinylallen, et lille, men kraftfuldt molekyle, er blevet syntetis…Kredit:Wiley Mange naturlige forbindelser, der bruges i medicin, har komplekse molekylære arkitekturer, som er svære at genskabe i laboratoriet. Hjælp kunne komme fra et lille kulbrintemolekyle, k
Anstrengt, symmetrisk, og nyt:Tetravinylallen, et lille, men kraftfuldt molekyle, er blevet syntetis…Kredit:Wiley Mange naturlige forbindelser, der bruges i medicin, har komplekse molekylære arkitekturer, som er svære at genskabe i laboratoriet. Hjælp kunne komme fra et lille kulbrintemolekyle, k -
 Innovativ kombination af hårde og bløde materialer forbedrer vedhæftningen til ru overfladerVedhæftning til ru overflader forbedres væsentligt ved kombinationen af to materialer. Den store model viser det grundlæggende princip og strukturen af de nye klæbemidler, hvor bløde materialer (g
Innovativ kombination af hårde og bløde materialer forbedrer vedhæftningen til ru overfladerVedhæftning til ru overflader forbedres væsentligt ved kombinationen af to materialer. Den store model viser det grundlæggende princip og strukturen af de nye klæbemidler, hvor bløde materialer (g -
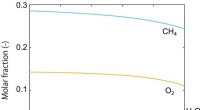 Ydeevne af methankonverteringsfast katalysator forudsiges ved teoretisk beregningFigur 1. Molfraktionsændring Molfraktion langs reaktionstiden (-erne) beregnet ved reaktorsimuleringen. Indløbsgassen bestod af CH4, O2, og He (som inert gas). Det samlede tryk blev sat til P =1 bar,
Ydeevne af methankonverteringsfast katalysator forudsiges ved teoretisk beregningFigur 1. Molfraktionsændring Molfraktion langs reaktionstiden (-erne) beregnet ved reaktorsimuleringen. Indløbsgassen bestod af CH4, O2, og He (som inert gas). Det samlede tryk blev sat til P =1 bar, -
 Forskere gør ananasaffald til aerogeler af høj værdiFormosa ananas i Filippinerne. Næsten tre gange så meget ananasbladaffald genereres for hvert kilo produceret frugt. Kredit:Judgefloro Høst af ananas, en udbredt tropisk frugt, efterlader tonsvis
Forskere gør ananasaffald til aerogeler af høj værdiFormosa ananas i Filippinerne. Næsten tre gange så meget ananasbladaffald genereres for hvert kilo produceret frugt. Kredit:Judgefloro Høst af ananas, en udbredt tropisk frugt, efterlader tonsvis
- Hvad er det karakteristiske symbol, der bruges til at identificere radioaktive materialer?
- En ny tilgang til Storbritanniens modstandsdygtighed er nødvendig
- Tumors in Space-projektet studerer kræftrisiko for kosmisk stråling
- EPA-handling øger græsrodsdriften for at reducere for evigt giftige kemikalier
- Hvorfor øges vandtrykket med dybde?
- Atombytning kan føre til ultralys, fleksible næste generations LED'er


