Hvordan KI formuleres til jodopløsning?
Sådan fungerer det:
1. reaktion: Når jod (i 2 ) føjes til en opløsning af kaliumiodid (KI), det reagerer med iodidionerne (i - ) til stede i løsningen til dannelse af triiodidionen (i 3 - ):
`` `
Jeg 2 (S) + i - (aq) ⇌ i 3 - (aq)
`` `
2. ligevægt: Reaktionen er en ligevægt, hvilket betyder, at den kan fortsætte i begge retninger. Imidlertid foretrækkes dannelsen af triiodidionen, hvilket fører til opløsning af jod.
3. opløselighed: Triiodidionen er opløselig i vand, i modsætning til elementær jod (i 2 ) hvilket kun er lidt opløseligt. Dette muliggør opløsning af en betydelig mængde jod i nærvær af KI.
Vigtig note: Mængden af anvendt ki bestemmer, hvor meget jod kan opløses. En højere koncentration af KI vil resultere i en højere koncentration af triiodidioner og derfor en større kapacitet til at opløse jod.
anvendelser:
Denne reaktion bruges i forskellige applikationer, herunder:
* Analytisk kemi: At fremstille standardopløsninger af jod til titrering.
* Medicin: Som forventet og til behandling af hypothyreoidisme.
* Fotografering: Ved at udvikle opløsninger til fjernelse af overskydende sølvhalogenidkrystaller fra film.
Generelt er dannelsen af det opløselige triiodidkompleks den vigtigste årsag til, at KI bruges til at opløse jod.
 Varme artikler
Varme artikler
-
 Kemikere, der overraskende opdagede nanokonfinerede reaktioner, kunne hjælpe med katalytisk designKredit:Georgia State University Georgia State University kemiforskere har afsløret et af mysterierne bag katalytiske reaktioner i mikroskopisk skala, giver mulighed for design af mere effektive in
Kemikere, der overraskende opdagede nanokonfinerede reaktioner, kunne hjælpe med katalytisk designKredit:Georgia State University Georgia State University kemiforskere har afsløret et af mysterierne bag katalytiske reaktioner i mikroskopisk skala, giver mulighed for design af mere effektive in -
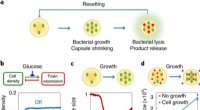 Programmerbare sværmbotter hjælper med at lave fleksible biologiske værktøjeren, Design koncept, hver sværmbot består af en lille population af konstruerede bakterier indkapslet i polymere mikrokapsler. Disse bakterier er konstrueret til at undergå delvis lysering ved en tilst
Programmerbare sværmbotter hjælper med at lave fleksible biologiske værktøjeren, Design koncept, hver sværmbot består af en lille population af konstruerede bakterier indkapslet i polymere mikrokapsler. Disse bakterier er konstrueret til at undergå delvis lysering ved en tilst -
 Forskere løser et videnskabeligt mysterium om fordampningHadi Ghasemi, Cullen lektor i maskinteknik ved University of Houston, ledet forskning, der eliminerer flaskehalsen, der har komplicerede forudsigelser og simuleringer af processer, der involverer ford
Forskere løser et videnskabeligt mysterium om fordampningHadi Ghasemi, Cullen lektor i maskinteknik ved University of Houston, ledet forskning, der eliminerer flaskehalsen, der har komplicerede forudsigelser og simuleringer af processer, der involverer ford -
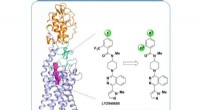 Forskere dechifrerer multi-domænet, struktur i fuld længde af den menneskelige glattede receptorStruktur af multi-domæne human Smoothened receptor, et vigtigt lægemiddelmål for kræftsygdomme. Kredit:ShanghaiTech University Et team af forskere ledet af iHuman Institute of ShanghaiTech Univers
Forskere dechifrerer multi-domænet, struktur i fuld længde af den menneskelige glattede receptorStruktur af multi-domæne human Smoothened receptor, et vigtigt lægemiddelmål for kræftsygdomme. Kredit:ShanghaiTech University Et team af forskere ledet af iHuman Institute of ShanghaiTech Univers
- Hvilket er følgende placering i periodisk tabel ville have mindst massivt atom?
- Bakterieceller er normalt meget større end eukaryotiske celler?
- NASA udvælger forslag til yderligere at studere rummets grundlæggende karakter
- Ny strategi for kiralitetskontrolleret syntese af enkeltvæggede carbon-nanorør
- Betydningen af fysik i den moderne verden
- Forskningssamarbejde kunne omforme sprøjtestøbning


