How do you calculate energy of activation in catalysis?
1. Arrhenius Equation:
Dette er den mest almindelige metode og involverer at studere reaktionshastigheder ved forskellige temperaturer. Arrhenius -ligningen er:
k =a * exp (-ea/rt)
Hvor:
* k is the rate constant of the reaction
* a is the pre-exponential factor (frequency factor)
* ea er aktiveringsenergien
* r er den ideelle gaskonstant (8.314 j/mol · k)
* t er den absolutte temperatur i Kelvin
For at beregne EA ved hjælp af Arrhenius -ligningen skal du:
* Mål hastighedskonstanten (k) ved to eller flere forskellige temperaturer.
* plot ln (k) versus 1/t. Dette giver dig en lige linje med en hældning af -a/r.
* Beregn hældningen af linjen og multiplicer den med -r for at få ea.
2. Eyring ligning (overgangstilstand teori):
Denne metode er mere kompleks, men kan give en mere nøjagtig værdi for EA. Det vedrører hastighedskonstanten til Gibbs frie aktiveringsenergi (ΔG ‡):
k =(k_b * t/h) * exp (-Δg ‡/rt)
Hvor:
* k_b er Boltzmann konstant
* h is the Planck constant
* ΔG‡ is the Gibbs free energy of activation
At beregne EA ved hjælp af Eyring -ligningen:
* Bestem Gibbs -frie aktiveringsenergi (ΔG ‡) ved hjælp af eksperimentelle data.
* Brug ligningen ΔG ‡ =ΔH ‡ - TΔS ‡ til at beregne entalpien af aktivering (ΔH ‡).
* ea =ΔH ‡ + rt.
3. Computational methods:
Avancerede beregningskemiske metoder kan bruges til at beregne aktiveringsenergien, især for komplekse reaktioner. Disse metoder involverer:
* Kvantemekaniske beregninger: These methods provide highly accurate values for Ea.
* Molekylær dynamik Simuleringer: Disse metoder simulerer bevægelsen af atomer og molekyler, så du kan få information om reaktionsvejen og aktiveringsenergien.
nøglepunkter at huske:
* katalysatorer sænker aktiveringsenergien i en reaktion, men de ændrer ikke ligevægtskonstanten. Dette betyder, at de fremskynder reaktionshastigheden, men påvirker ikke de endelige mængder reaktanter og produkter i ligevægt.
* Aktiveringsenergiværdier udtrykkes typisk i enheder af joule pr. mol (J/mol) eller kilojoules pr. Mol (KJ/mol).
Valg af den rigtige metode:
Valget af metode afhænger af de tilgængelige eksperimentelle data, kompleksiteten af reaktionen og det ønskede nøjagtighedsniveau. The Arrhenius equation is suitable for simple reactions with readily available rate constant data. Eyring -ligningen er mere præcis, men kræver yderligere oplysninger om overgangstilstanden. Beregningsmetoder tilbyder høj nøjagtighed, men kræver specialiseret software og ekspertise.
 Varme artikler
Varme artikler
-
 Forskere udvikler overfladesyre- og selektivitetsjusterbar manganoxidkatalysatorKredit:CC0 Public Domain En forskergruppe ledet af prof. Xu Jie fra Dalian Institute of Chemical Physics (DICP) under det kinesiske videnskabsakademi har udviklet en overfladesurheds- og selektivi
Forskere udvikler overfladesyre- og selektivitetsjusterbar manganoxidkatalysatorKredit:CC0 Public Domain En forskergruppe ledet af prof. Xu Jie fra Dalian Institute of Chemical Physics (DICP) under det kinesiske videnskabsakademi har udviklet en overfladesurheds- og selektivi -
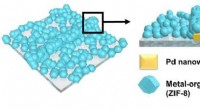 Ultrahurtig og ultrafølsom hydrogensensorRepræsentativt billede af dette papir udgivet i ACS Nano den 26. september Kredit:KAIST Et KAIST-team lavede en ultrahurtig hydrogensensor, der kan detektere hydrogengasniveauer under 1% på mind
Ultrahurtig og ultrafølsom hydrogensensorRepræsentativt billede af dette papir udgivet i ACS Nano den 26. september Kredit:KAIST Et KAIST-team lavede en ultrahurtig hydrogensensor, der kan detektere hydrogengasniveauer under 1% på mind -
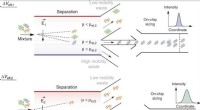 Mikrofluidik:2-D fingeraftryk af heterogene proteiner i opløsningOn-chip separation og analyse af blandinger i væskefase. Ved at justere den effektive spænding, Δveff, molekyler med en specifik elektroforetisk mobilitet, μ = μel, og dermed et specifikt forhold mell
Mikrofluidik:2-D fingeraftryk af heterogene proteiner i opløsningOn-chip separation og analyse af blandinger i væskefase. Ved at justere den effektive spænding, Δveff, molekyler med en specifik elektroforetisk mobilitet, μ = μel, og dermed et specifikt forhold mell -
 Fra medicin til nanoteknologi:Hvordan guld stille og roligt former vores verdenKredit:itti ratanakiranaworn/Shutterstock Det periodiske system med kemiske grundstoffer fylder 150 i år. Jubilæet er en chance for at skinne lys over bestemte elementer - hvoraf nogle virker alle
Fra medicin til nanoteknologi:Hvordan guld stille og roligt former vores verdenKredit:itti ratanakiranaworn/Shutterstock Det periodiske system med kemiske grundstoffer fylder 150 i år. Jubilæet er en chance for at skinne lys over bestemte elementer - hvoraf nogle virker alle
- Ændring af havenes modstandsdygtighed over for klimaændringer
- AI og maskinlæring hjælper videnskabsmænd med at forstå menneskelig ansigtsgenkendelse
- Reduktion af plastikaffald vil kræve grundlæggende kulturændringer
- Sådan beregnes rekombinationsfrekvenser
- Cadmiumselenid kvanteprikker nedbrydes i jord, frigør deres giftige indvolde
- Hvad er 8 grader sydlig breddegrad og 177 østlig længdegrad?


