Hvad har forudsigelige kemiske egenskaber?
Her er en sammenbrud:
* alkalimetaller (gruppe 1): Meget reaktive metaller, der let mister et elektron til dannelse af +1 ioner.
* alkaliske jordmetaller (gruppe 2): Reaktive metaller, der mister to elektroner til dannelse af +2 ioner.
* halogener (gruppe 17): Meget reaktive ikke -metaller, der får en elektron til dannelse af -1 -ioner.
* ædle gasser (gruppe 18): Meget ureaktiv på grund af deres fulde ydre skal af elektroner.
Eksempel:
Alle alkalimetaller reagerer kraftigt med vand for at producere brintgas og et metalhydroxid. Dette skyldes, at de alle har en valenselektron, som de let donerer, hvilket fører til lignende kemiske reaktioner.
Andre faktorer, der påvirker kemiske egenskaber:
Mens elementer inden for den samme gruppe har lignende kemiske egenskaber, kan andre faktorer også påvirke deres opførsel, såsom:
* atomstørrelse: Større atomer har svagere attraktioner til deres valenselektroner, hvilket gør dem mere reaktive.
* Elektronegativitet: Et atoms tendens til at tiltrække elektroner. Flere elektronegative elementer har en tendens til at danne mere stabile negative ioner.
* ioniseringsenergi: Den energi, der kræves for at fjerne et elektron fra et atom. Lavere ioniseringsenergier antyder en større tendens til at miste elektroner og danne positive ioner.
Afslutningsvis udviser elementer inden for den samme gruppe af den periodiske tabel generelt forudsigelige kemiske egenskaber på grund af deres lignende antal valenselektroner. Imidlertid påvirker andre faktorer også deres opførsel, hvilket fører til variationer inden for hver gruppe.
Sidste artikelEr et atom med seks elektroner mere stabile end én?
Næste artikelHvor er elementer med det samme antal valenselektroner?
 Varme artikler
Varme artikler
-
 Højstyrke pultruderede termoplastiske kompositter lavet af nyt råmaterialeDet venstre foto viser fremstillingen af termoplastisk fladt laminat på en pultruderingsmaskine:Strimler af kildemateriale tilføres fra venstre, med kompositprofilerne trukket ud til højre. Det ande
Højstyrke pultruderede termoplastiske kompositter lavet af nyt råmaterialeDet venstre foto viser fremstillingen af termoplastisk fladt laminat på en pultruderingsmaskine:Strimler af kildemateriale tilføres fra venstre, med kompositprofilerne trukket ud til højre. Det ande -
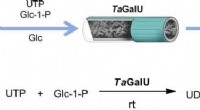 Trin for trin til slutproduktet gennem enzymkatalyseGrafisk abstrakt. Kredit:DOI:10.1016/j.cej.2021.131439 Enzymer (f.eks. dem, der stammer fra bakterier) kan omdanne en lang række forskellige udgangsmaterialer til et væld af målprodukter. Den såka
Trin for trin til slutproduktet gennem enzymkatalyseGrafisk abstrakt. Kredit:DOI:10.1016/j.cej.2021.131439 Enzymer (f.eks. dem, der stammer fra bakterier) kan omdanne en lang række forskellige udgangsmaterialer til et væld af målprodukter. Den såka -
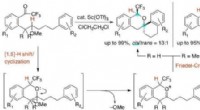 Ny syntese af komplekse organiske molekyler afsløretVi udviklede en effektiv metode til diastereoselektiv syntese af CF3-substituerede spiroisochromaner via C(sp3)¬-H-bindingsfunktionalisering, der involverer sekventielle transformationer ([1, 5] -hydr
Ny syntese af komplekse organiske molekyler afsløretVi udviklede en effektiv metode til diastereoselektiv syntese af CF3-substituerede spiroisochromaner via C(sp3)¬-H-bindingsfunktionalisering, der involverer sekventielle transformationer ([1, 5] -hydr -
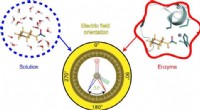 Kortlægning af elektriske felter for at hjælpe med at opklare, hvordan enzymer virkerGrafisk abstrakt. Kredit:Nature Chemistry (2022). DOI:10.1038/s41557-022-00937-w Hvert øjeblik i vores krops celler forekommer utallige aktiviteter, der er livsvigtige, takket være enzymer. Disse s
Kortlægning af elektriske felter for at hjælpe med at opklare, hvordan enzymer virkerGrafisk abstrakt. Kredit:Nature Chemistry (2022). DOI:10.1038/s41557-022-00937-w Hvert øjeblik i vores krops celler forekommer utallige aktiviteter, der er livsvigtige, takket være enzymer. Disse s


