Hvorfor er et molekyleatomer så langt væk fra hinanden, de kan få?
1. Tiltrækning:
* Elektrostatisk attraktion: Modsat ladede partikler tiltrækker. Elektroner tiltrækkes af den positivt ladede kerne af et atom. Denne attraktion er stærkest, når elektronerne er tættere på kernen.
* kovalent binding: I en kovalent binding deler atomer elektroner. Denne deling skaber en region med høj elektrondensitet mellem atomerne, der tiltrækker både kerner og holder atomerne sammen.
2. Afvisning:
* Elektronelektronafvisning: Elektroner, der er negativt ladet, afviser hinanden. Denne frastødelse bliver betydelig, når elektronerne er tæt på hinanden.
* nucleus-nucleus frastødning: De positivt ladede kerner af atomer afviser også hinanden.
Afstanden mellem atomer i et molekyle er den afstand, hvor de attraktive kræfter og frastødende kræfter er afbalanceret. Denne afstand er kendt som obligationslængde .
Faktorer, der påvirker bindingslængden:
* type obligation: Dobbelt- og tredobbeltbindinger er generelt kortere end enkeltbindinger på grund af den højere elektrondensitet mellem atomerne.
* Størrelse på atomer: Større atomer har længere bindingslængder, fordi deres kerner er længere fra hinanden.
* Elektronegativitet: Atomer med højere elektronegativitet tiltrækker elektroner stærkere, hvilket fører til kortere bindingslængder.
* Hybridisering: Hybridisering af atomiske orbitaler kan påvirke bindingslængder.
Hvorfor atomer ikke altid er så langt fra hinanden som muligt:
* stabilitet: Den afbalancerede tilstand af attraktive og frastødende kræfter giver den laveste energistilstand, hvilket gør molekylet mere stabil.
* binding: Atomer skal være tæt nok til at dele elektroner og danne en kovalent binding.
* Intermolekylære kræfter: Selvom atomer inden for et molekyle er i en bestemt afstand, kan molekylerne i sig selv tiltrækkes af hinanden gennem forskellige intermolekylære kræfter.
Derfor er afstanden mellem atomer i et molekyle et kompromis mellem behovet for tiltrækning, frastødelse og stabilitet. Det handler ikke om at være så langt fra hinanden som muligt, men snarere om at finde den optimale afstand for det specifikke molekyle.
 Varme artikler
Varme artikler
-
 Ny undersøgelse af grøn te potentiale til at hjælpe med at tackle COVID-19Kredit:Unsplash/CC0 Public Domain Mens Indien fortsætter med at være hærget af pandemien, en akademiker fra Swansea University undersøger, hvordan grøn te kan give anledning til et lægemiddel, der
Ny undersøgelse af grøn te potentiale til at hjælpe med at tackle COVID-19Kredit:Unsplash/CC0 Public Domain Mens Indien fortsætter med at være hærget af pandemien, en akademiker fra Swansea University undersøger, hvordan grøn te kan give anledning til et lægemiddel, der -
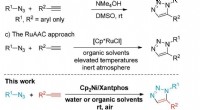 Team præsenterer ny syntesemetode til klikkemiSammenligningen af den eksisterende syntesemetode og den nyudviklede syntesemetode af professor Hong. Kredit:UNIST En nylig undersøgelse foretaget af forskere tilknyttet UNIST har præsenteret en
Team præsenterer ny syntesemetode til klikkemiSammenligningen af den eksisterende syntesemetode og den nyudviklede syntesemetode af professor Hong. Kredit:UNIST En nylig undersøgelse foretaget af forskere tilknyttet UNIST har præsenteret en -
 Medicin du kan bæreKredit:Swiss Federal Laboratories for Materials Science and Technology Narkotikafrigørende tekstiler kunne, for eksempel, bruges til at behandle hudsår. Empa-forskere er i øjeblikket ved at udvikl
Medicin du kan bæreKredit:Swiss Federal Laboratories for Materials Science and Technology Narkotikafrigørende tekstiler kunne, for eksempel, bruges til at behandle hudsår. Empa-forskere er i øjeblikket ved at udvikl -
 Chokolade, te eller kaffe med zink kan reducere oxidativ stressKredit:CC0 Public Domain Aldring og lav levealder er forårsaget, i hvert fald delvist, ved oxidativ stress. Et team af forskere ledet af prof. Dr. Ivana Ivanovi-Burmazovi fra formanden for bio-org
Chokolade, te eller kaffe med zink kan reducere oxidativ stressKredit:CC0 Public Domain Aldring og lav levealder er forårsaget, i hvert fald delvist, ved oxidativ stress. Et team af forskere ledet af prof. Dr. Ivana Ivanovi-Burmazovi fra formanden for bio-org
- Det elskede 600 år gamle hvide egetræ tager den sidste bue
- Kønsforskelle er stadig for mange kvindelige videnskabsmænd, viser undersøgelsen
- Små partikler fører til lysere skyer i troperne
- Grundvandsudtømning i US High Plains fører til dystre udsigter for kornproduktion
- Grækenland lønner tabt kamp mod albanske krydderurter
- Millioner af landmænd ligger i verdens største delta


