Hvad er elektronkonfigurationen af CI?
Her er elektronkonfigurationen af klor:
1S² 2S² 2P⁶ 3S² 3P⁵
Her er en sammenbrud:
* 1S²: Det første energiniveau (n =1) har to elektroner i S -orbitalen.
* 2s²: Det andet energiniveau (n =2) har to elektroner i S -orbitalen.
* 2p⁶: Det andet energiniveau (n =2) har seks elektroner i P orbital.
* 3S²: Det tredje energiniveau (n =3) har to elektroner i S -orbitalen.
* 3p⁵: Det tredje energiniveau (n =3) har fem elektroner i P -orbitalen.
Du kan også repræsentere dette ved hjælp af den ædle gas korthed:
[ne] 3s² 3p⁵
Dette indikerer, at klor har den samme indre elektronkonfiguration som neon (1S² 2S² 2P⁶) og derefter tilføjer de resterende elektroner i det tredje energiniveau.
 Varme artikler
Varme artikler
-
 Jern-medieret kræftcelle aktivitet:En ny reguleringsmekanismeMesenkymale stamceller (til højre) er forbundet med metastatisk spredning, modstandsdygtighed over for konventionel kemoterapi og tilbagefald. Under overgangen til denne tilstand, proteinet CD44 overt
Jern-medieret kræftcelle aktivitet:En ny reguleringsmekanismeMesenkymale stamceller (til højre) er forbundet med metastatisk spredning, modstandsdygtighed over for konventionel kemoterapi og tilbagefald. Under overgangen til denne tilstand, proteinet CD44 overt -
 Kemikere kommer et skridt tættere på at replikere naturen med samling af nye 3D-strukturerKredit:CC0 Public Domain Et hold af New York University kemikere har skabt en række tredimensionelle strukturer, der tager et skridt tættere på at ligne dem, der findes i naturen. Værket giver ind
Kemikere kommer et skridt tættere på at replikere naturen med samling af nye 3D-strukturerKredit:CC0 Public Domain Et hold af New York University kemikere har skabt en række tredimensionelle strukturer, der tager et skridt tættere på at ligne dem, der findes i naturen. Værket giver ind -
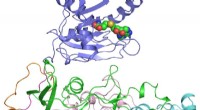 Forskere knækker strukturen af nøgleprotein i Zika-virusKrystalstrukturen af ZIKV NS5-protein. Regionerne med forskellige farver repræsenterer individuelle domæner eller motiver af ZIKV NS5. Den sorte cirkel markerer placeringen af det potentielle inhi
Forskere knækker strukturen af nøgleprotein i Zika-virusKrystalstrukturen af ZIKV NS5-protein. Regionerne med forskellige farver repræsenterer individuelle domæner eller motiver af ZIKV NS5. Den sorte cirkel markerer placeringen af det potentielle inhi -
 Hydrofobe molekylers rolle i katalytiske reaktionerKredit:CC0 Public Domain Elektrokemiske processer kan bruges til at omdanne CO 2 til nyttige udgangsmaterialer til industrien. For at optimere processerne, kemikere forsøger i detaljer at beregn
Hydrofobe molekylers rolle i katalytiske reaktionerKredit:CC0 Public Domain Elektrokemiske processer kan bruges til at omdanne CO 2 til nyttige udgangsmaterialer til industrien. For at optimere processerne, kemikere forsøger i detaljer at beregn
- Ny metode kan effektivt skabe flere byggesten af farmaceutiske lægemidler
- Paul Crutzen, der delte Nobel for ozonarbejde, er død
- Tesla uden moskus ved rattet? Det er, hvad SEC ønsker
- Hvad er breddegrad og længdegrad for Fort Pierce Florida?
- Ved at holde vejene i god form reduceres drivhusgasemissionerne, undersøgelse finder
- Hvad hvis en asteroide var ved at ramme Jorden? Forskere overvejer spørgsmål


